CAPITULO XVII
ALIMENTOS DE REGIMEN O DIETETICOS
Art 1339 - (Res. Conj. 94/2008 SPReI y 357/2008 SAGPyA) - Se entiende por ‘Alimentos dietéticos’ o ‘Alimentos para regímenes especiales’ a los alimentos envasados preparados especialmente que se diferencian de los alimentos ya definidos por el presente Código por su composición y/o por sus modificaciones físicas, químicas, biológicas o de otra índole resultantes de su proceso de fabricación o de la adición, sustracción o sustitución de determinadas substancias componentes.
Están destinados a satisfacer necesidades particulares de nutrición y alimentación de determinados grupos poblacionales.
Se clasifican en:
a) Alimentos para satisfacer necesidades alimentarias específicas de determinados grupos de personas sanas:
— Alimentos para lactantes y niños de corta edad.
— Alimentos fortificados.
— Alimentos que proporcionan por adición, nutrientes esenciales.
— Alimentos en los que se han restaurado nutrientes perdidos en el proceso de elaboración.
— Alimentos adicionados con fibra.
b) Alimentos para satisfacer necesidades alimentarias de personas que presentan estados fisiológicos particulares:
— Alimentos modificados en su valor energético.
— Alimentos modificados en su composición glucídica.
— Alimentos modificados en su composición proteica.
— Alimentos modificados en su composición lipídica.
— Alimentos modificados en su composición mineral.
— Alimentos de bajo contenido de sodio.
— Alimentos libres de gluten.
c) ‘Alimentos enriquecidos’.
d) ‘Suplementos dietarios’.
e) ‘Alimentos con propóleos’.
Art 1340
- (Res. Conj. 161/2008 SPReI y 244/2008 SAGPyA) - Los Alimentos Dietéticos o Alimentos para Regímenes Especiales deberán ajustarse a las siguientes normas microbiológicas:
Art 1341 - (Res 1505, 10.08.88) "Los alimentos dietéticos o para régimenes especiales deberán ser acondicionados en su lugar de elaboración o en otras plantas de la misma empresa en envases que satisfagan las exigencias del presente Código y rotulados reglamentariamente, quedando expresamente prohibido el fraccionamiento y expendio a granel o al detalle".
Art 1342 - (Res 1542, 12.09.90) "Los alimentos dietéticos o para régimenes especiales serán de venta libre y podrán expenderse por las mismas vías de comercialización de los demás alimentos".
Art 1343 - (Res 1505, 10.08.88) "En los rótulos, informaciones o anuncios por cualquier medio de los alimentos dietéticos o para régimenes especiales, no podrá hacerse mención de su empleo en determinados estados patológicos, con las excepciones previstas en el presente Código.
Los alimentos dietéticos o para régimenes especiales no deberán describirse ni presentarse en forma que sea falsa, equívoca o engañosa o susceptible de crear una impresión errónea respecto a su naturaleza en ningún aspecto".
Art 1344 - (Res 1505, 10.08.88) "En los alimentos dietéticos se admite el empleo de los aditivos autorizados para los alimentos correspondientes ya definidos en el presente Código, en las cantidades máximas establecidas por el mismo, salvo en las excepciones previstas".
Art 1345 - (Res 1551, 12.09.90) "En el rotulado de todos los alimentos dietéticos o para régimenes especiales deberán figurar las indicaciones del Artículo 223, las requeridas al alimento correspondiente ya definido en el presente Código que resulten aplicables, las siguientes indicaciones generales y las que en cada caso particular se determinen:
a) Deberá consignar la denominación específica del producto con caracteres de buen tamaño, realce y visibilidad (por ejemplo: pan, leche, margarina) y próxima a ella la indicación de la característica esencial (por ejemplo: fortificado con proteínas, de bajo contenido glucídico) con caracteres no menores del 50% del tamaño de los empleados en la denominación específica y de buen realce y visibilidad.
b) La composición química porcentual (hidratos de carbono asimilables y/o proteínas y/o lípidos y/o fibra (cruda y/o dietaria)) según corresponda.
c) La lista completa de ingredientes a excepción del agua según el orden decreciente de sus proporciones.
d) La lista completa de aditivos mediante expresiones que identifiquen la clase o tipo de aditivo empleado (por ejemplo: "antioxidante permitido", "emulsionante permitido", "colorante permitido") con las siguientes excepciones, en cuyo caso deberán declararse además de su función, la designación específica (colorante: tartrazina; conservador: ácido benzoico, dióxido de azufre; edulcorante no nutritivo: sacarina, ciclamato, aspartamo).
e) El valor energético, expresado en calorías (kilocalorías) por 100 g ó 100 cm3 de producto. Podrá indicarse además el valor energético por porción especificada de consumo del mismo.
f) Las condiciones de almacenamiento del producto y las condiciones de conservación una vez abierto, cuando la autoridad sanitaria competente lo considere necesario.
La indicación Alimento Dietético o Alimento para Regímenes Especiales podrá figurar en el rotulado.
Cuando el producto contenga edulcorantes no nutritivos dicha indicación será obligatoria y deberá figurar en el rótulo principal de acuerdo a las exigencias del Artículo 1349.
(Res 305 del 26.03.93) - "Para el cálculo del valor energético se considerará el siguiente aporte:
Art 1346 - (Res 1505, 10.08.88) "Todo establecimiento que elabora alimentos dietéticos ó para régimenes especiales comprendidos en este capítulo, deberá contar con la Dirección Técnica de un profesional universitario que por la naturaleza de sus estudios a juicio de la autoridad sanitaria nacional, está capacitado para dichas funciones, el que además asumirá conjuntamente con la empresa la responsabilidad ante las autoridades sanitarias de la calidad de los productos elaborados.
Las empresas elaboradoras deberán asegurar el control analítico de las materias primas, productos en elaboración y productos terminados".
Art 1346 bis - (Res. Conj. 87/2008 SPReI 340/2008 SAGPyA)- ‘Todo establecimiento que elabore/industrialice y/o fraccione alimentos en polvo para lactantes incluidos en las Categorías a y b del Artículo 1353 del C.A.A., que requieran ser reconstituidos para su consumo, deberá implementar un Sistema de Análisis de Peligros y Puntos Críticos de Control (HACCP) de acuerdo a las directrices que constan en el Artículo 18 bis del presente Código’".
Art 1347 - (Res 1542, 12.09.90) "Se entiende por endulzante o edulcorante de mesa a los edulcorantes no nutritivos definidos en el Artículo 1348 y a los nuevos que la Autoridad Sanitaria Nacional apruebe en el futuro, usados solos, sus mezclas o mezclados con azúcares nutritivos.
Según su composición se distinguen dos clases de edulcorantes de mesa:
a) los elaborados con edulcorantes no nutritivos solos o sus mezclas.
b) los elaborados con edulcorantes no nutritivos (solos o sus mezclas) adicionados con azúcares nutritivos, siempre y cuando dicha mezcla, a igualdad de peso, sea como mínimo 10 veces más dulce que la sacarosa.
Como excepción a los alcances del Artículo 235, se permite su presentación en forma de tabletas, líquidos por gotas o en polvo.
En la elaboración de los edulcorantes de mesa se permite la adición de:
autorizados por el presente Código en las proporciones necesarias para obtener un resultado tecnológico.
Estos productos se rotularán Endulzantes o Edulcorantes de Mesa y deberán cumplir con todo lo estipulado en el Artículo 1345".
Art 1347 bis - (Res 1505, 10.08.88) "Los alimentos dietéticos deberán responder en lo general a las normas establecidas para su equivalente codificado, excepto las modificaciones introducidas inherentes a su carácter dietético y en lo particular a las que en cada caso se exijan".
Art 1348 - (Res 1505, 10.08.88) "Se consideran
edulcorantes no nutritivos la Sacarina y sus sales sódica o cálcica; el
Ciclamato y sus sales sódica o cálcica y el Aspartamo.
Para la sacarina se considera una ingesta diaria admisible
(IDA)(como ácido) de 0 2,5 mg/kg de peso corporal; para el ciclamato
(como ácido) de 0 - 11 mg/kg de peso corporal; y para el aspartamo de
0 - 40 mg/kg de peso corporal".
Art 1349 - (Res 1542, 12.09.90) "Los alimentos autorizados por el presente Código para emplear edulcorantes no nutritivos deberán ser considerados dietéticos y deberán consignar en el rótulo principal la leyenda Alimento o Bebida Dietética o Alimento o Bebida para Regímenes Especiales a continuación de la designación específica y con igual tamaño de letra.
Deberán consignar las concentraciones en mg/100g ó 100 cm3 de los edulcorantes no nutritivos empleados con caracteres de un tamaño no menor de 1,5 mm de altura.
Para el Aspartamo deberá cumplirse además con las restricciones de uso y requisitos de rotulación establecidos en el Art 1398.30.1".
ALIMENTOS PARA LACTANTES Y NIÑOS EN LA PRIMERA INFANCIA
Art 1350 - (Res 1505, 10.08.88) "Se entenderá por lactantes a los niños de hasta doce meses de edad desde su nacimiento.
Se entenderá por Primera Infancia a los niños de más de 1 año y hasta los 2 años de edad.
Los alimentos para lactantes tendrán por finalidad la alimentación durante los primeros meses de su vida, y los de la primera infancia a los que se utilizan para la adaptación progresiva a la normal de la segunda infancia".
Art 1351 - (Res 1505, 10.08.88) "Todo alimento destinado al lactante o a la primera infancia, deberá llevar en el rótulo la leyenda Consulte a su Médico, con letras de una altura no menor de 2 mm, de buen tono, realce y visibilidad".
Art 1352 - (Res 1505, 10.08.88) "Los alimentos destinados a los lactantes y a la primera infancia deberán satisfacer los siguientes requisitos:
1. Sólo podrán contener los componentes adecuados para la edad del niño a que están destinados.
2. Las materias primas deberán satisfacer las máximas condiciones de calidad.
3. Los productos terminados deberán estar exentos de hormonas, antibióticos y prácticamente libres de residuos de plaguicidas.
4. No deberán contener substancias colorantes artificiales, conservantes ni antioxidantes sintéticos.
5. Podrán llevar el agregado de nutrientes en la cantidad requerida para cumplimentar las exigencias normales de la edad a que están destinados".
Art 1353 - (Res 1505, 10.08.88) "Los alimentos para lactantes y niños en la primera infancia pueden ser de las siguientes categorías:
a) Los preparados líquidos o en polvo que por su composición puedan sustituir parcial o totalmente la alimentación específica (leche maternizada);
b) Los preparados para una alimentación inespecífica del lactante sano (leches modificadas);
c) Los preparados para la adaptación del lactante a la alimentación de la primer infancia:
1. Harinas dietéticas
2. Preparados en base a vegetales, carne, hígado, huevos, frutas, etc.
Pueden presentarse en forma de pasta, polvo, puré, etc.
En el rótulo de estos preparados debe manifestarse las materias primas utilizadas, y el valor energético".
Art 1354 - (Res 1505, 10.08.88) "Todo alimento para lactantes deberá llevar en el rótulo la manifestación cuali y cuantitativa de sus principios alimenticios, incluyendo el contenido en calcio, Vitaminas C y D. Tratándose de preparaciones sólidas que deban utilizarse previa disolución o suspensión en agua u otro medio apropiado, la técnica de su preparación y la porcentualidad de los principios alimenticios que aporte el producto listo para su consumo".
Art 1355 - (Res 1505, 10.08.88) "Todo alimento destinado al lactante que hubiere sido acidificado por acidificación biológica o por agregado de ácido láctico, deberá expresar en el rótulo el contenido de dicho ácido por 100 g de producto".
Art 1356 - (Res 1505, 10.08.88) "Todo preparado para la alimentación inespecífica del lactante y los preparados para una alimentación de transición, así como también los preparados para la primera infancia, podrán ser autorizados previa información satisfactoria de no menos de tres profesionales médicos especializados (pediatras) pertenecientes a la autoridad sanitaria o a los que ésta designe a ese efecto para cada caso particular".
Art 1357 - (Res 1505, 10.08.88) "Todo alimento dietético para lactantes o para niños en la primera infancia deberá llevar en su rotulado la fecha de elaboración y la de vencimiento o la fecha de vencimiento"
Art 1358 - (Res 1505, 10.08.88) "Se entiende por Leche Modificada la que, sometida a tratamientos especiales o que por adición de diferentes principios alimenticios o sustitución parcial de algunos de los propios, transforma sus propiedades físicas o altera la relación porcentual de sus constituyentes originales (leche maternizada, babeurre, etc).
Las que se expendan en forma fluida deberán ser esterilizadas.
Las leches modificadas en polvo, ácidas o acidificadas, al reconstruirse con la cantidad conveniente de agua, no presentarán una acidez superior a 1,0 g por 100 ml expresada en ácido láctico".
Art 1359 - (Res 1505, 10.08.88) "Se entiende por Harinas Dietéticas los productos destinados para adaptar al lactante a la alimentación de la primera infancia y a los apropiados por su composición a los niños comprendidos en esta última categoría y estarán constituidos en general por: harinas de cereales o legumbres, materias amiláceas o sus derivados (dextrinas, maltosa, etc.), con el agregado de otros alimentos como leche en polvo, huevo en polvo, grasas alimenticias, glúcidos, minerales, vitaminas, proteínas y sometidos a tratamientos especiales para hacerlas más digeribles".
Art 1359 bis - (Res Conj 97/2007 y 301/2007, 18.07.07)
a) El objetivo del Código Internacional de Comercialización de
Sucedáneos de la Leche Materna de la Organización Mundial de la
Salud (O.M.S.), Ginebra, 1981 es contribuir a proporcionar a los lactantes una
nutrición segura y suficiente, protegiendo y promoviendo la lactancia
natural y asegurando el uso correcto de los sucedáneos de la leche materna,
cuando éstos sean necesarios, sobre la base de una información
adecuada y mediante métodos apropiados de comercialización y distribución.
b) El Código Internacional de Comercialización de Sucedáneos
de la Leche Materna se aplica a la comercialización y prácticas
con ésta relacionadas de los siguientes productos: sucedáneos
de la leche materna, incluidas las preparaciones para lactantes; otros productos
de origen lácteo, alimentos y bebidas, incluidos los alimentos complementarios
administrados con biberón, cuando están comercializados o cuando
de otro modo se indique que pueden emplearse, con o sin modificación,
para sustituir parcial o totalmente a la leche materna; los biberones y tetinas.
Se aplica asimismo a la calidad y disponibilidad de los productos antedichos
y a la información relacionada con su utilización.
c) A los únicos efectos de la aplicación del Código Internacional
de Comercialización de Sucedáneos de la Leche Materna de la Organización
Mundial de la Salud se entiende por: "Alimento complementario": todo alimento,
manufacturado o preparado localmente que convenga como complemento de la leche
materna o de las preparaciones para lactantes cuando aquélla o éstas
resulten insuficientes para satisfacer las necesidades nutricionales del lactante.
Ese tipo de alimento se suele llamar también "alimento de destete" o
"suplemento de la leche materna".
"Comercialización": las actividades de promoción, distribución,
venta, publicidad, relaciones públicas y servicios de información
relativas a un producto.
"Distribuidor": una persona, una sociedad o cualquier otra entidad que, en el
sector público o privado, se dedique (directa o indirectamente) a la
comercialización, al por mayor o al detalle, de algunos de los productos
comprendidos en las disposiciones del presente artículo en concordancia
con el Código Internacional de Comercialización de Sucedáneos
de la Leche Materna de la Organización Mundial de la Salud. Un "distribuidor
primario" es un agente de ventas, representante, distribuidor nacional o corredor
de un fabricante.
"Envase": toda forma de embalaje de los productos para su venta al detalle por
unidades normales, incluido el envoltorio.
"Etiqueta": todo marbete, marca, rótulo u otra indicación gráfica
descriptiva, escrita, impresa, estarcida, marcada, grabada en relieve o en hueco
o fijada sobre un envase de cualquiera de los productos comprendidos en el Código
Internacional de Comercialización de Sucedáneos de la Leche Materna
de la Organización Mundial de la Salud.
"Fabricante": toda empresa u otra entidad del sector público o privado
que se dedique al negocio o desempeñe la función (directamente
o por conducto de un agente o de una entidad controlados por ella o a ella vinculados
en virtud de un contrato) de fabricar alguno de los productos comprendidos en
las disposiciones del Código Internacional de Comercialización
de Sucedáneos de la Leche Materna de la Organización Mundial de
la Salud.
"Muestras": las unidades o pequeñas cantidades de un producto que se
facilitan gratuitamente.
"Personal de comercialización": toda persona cuyas funciones incluyen
la comercialización de uno o varios productos comprendidos en las disposiciones
del Código Internacional de Comercialización de Sucedáneos
de la Leche Materna de la Organización Mundial de la Salud.
"Preparación para lactantes": todo sucedáneo de la leche materna
preparado industrialmente, de conformidad con las normas aplicables del Codex
Alimentarius, para satisfacer las necesidades nutricionales normales de los
lactantes hasta la edad de 4 a 6 meses y adaptado a sus características
fisiológicas; esos alimentos también pueden ser preparados en
el hogar, en cuyo caso se designan como tales.
"Sucedáneo de la leche materna": todo alimento comercializado o de otro
modo presentado como sustitutivo parcial o total de la leche materna, sea o
no adecuado para ese fin.
"Suministros": las cantidades de un producto facilitadas para su utilización
durante un período prolongado, gratuitamente o a bajo precio, incluidas
las que se proporcionan, por ejemplo, a familias menesterosas.
Durante el período comprendido entre los cuatro y los seis primeros meses
de vida, solamente la leche materna suele ser adecuada para satisfacer las necesidades
nutricionales del lactante normal. A lo largo de ese período puede reemplazarse
(sustituirse) la leche materna por sucedáneos auténticos de ésta,
incluidas las preparaciones para lactantes. Cualesquiera otros alimentos, como
leche de vaca, jugos de fruta, cereales, hortalizas o cualquier otro producto
alimenticio líquido, sólido o semisólido destinado a lactantes,
y administrados después de éste período inicial, no pueden
considerarse ya como sustitutivos de la leche materna (o como sucedáneos
auténticos de ésta). Tales productos alimenticios se limitan a
complementar la leche materna o sus sucedáneos y, por consiguiente, el
proyecto de código se refiere a ellos denominándolos alimentos
complementarios; suelen también denominarse alimentos de destete o suplementos
de la leche materna.
Los productos que no son sucedáneos auténticos de la leche materna,
incluidas las preparaciones para lactantes, sólo están comprendidos
en el ámbito de aplicación del código cuando están
"comercializados o cuando de otro modo se indique que pueden emplearse... para
sustituir parcial o totalmente a la leche materna". Así, pues, la mención
del código a los productos que se emplean como sustitutivos parciales
o totales de la leche materna no debe entenderse referida a los alimentos complementarios,
a no ser que tales alimentos sean de hecho comercializados (como los sucedáneos
de la leche materna, incluidas las preparaciones para lactantes) como aptos
para sustituir parcial o totalmente a aquélla. En tanto los fabricantes
y distribuidores no promuevan la venta de sus productos como susceptibles de
sustituir parcial o totalmente a la leche materna, las normas del código
sobre limitaciones en cuanto a la publicidad y otras actividades de promoción
de los mismos no les serán aplicables.
d) Información y educación
• Los gobiernos deben asumir la responsabilidad de garantizar que se facilita
a las familias y a las personas relacionadas con el sector de la nutrición
de los lactantes y los niños de corta edad una información objetiva
y coherente. Esa responsabilidad debe abarcar sea la planificación, la
distribución, la concepción y la difusión de la información,
sea el control de esas actividades.
• Los materiales informativos y educativos, impresos, auditivos o visuales,
relacionados con la alimentación de los lactantes y destinados a las
mujeres embarazadas y a las madres de lactantes y niños de corta edad,
deben incluir datos claramente presentados sobre todos y cada uno de los siguientes
extremos: ventajas y superioridad de la lactancia natural; nutrición
materna y preparación para la lactancia natural y el mantenimiento de
ésta; efectos negativos que ejerce sobre la lactancia natural la introducción
parcial de la alimentación con biberón, dificultad de volver sobre
la decisión de no amamantar al niño y uso correcto, cuando sea
necesario, de preparaciones para lactantes fabricadas industrialmente o hechas
en casa.
• Cuando dichos materiales contienen información acerca del empleo
de preparaciones para lactantes, deben señalar las correspondientes repercusiones
sociales y financieras, los riesgos que presentan para la salud los alimentos
o los métodos de alimentación inadecuados y, sobre todo, los riesgos
que presenta para la salud el uso innecesario o incorrecto de preparaciones
para lactantes y otros sucedáneos de la leche materna. Con ese material
no deben utilizarse imágenes o textos que puedan idealizar el uso de
sucedáneos de la leche materna.
• Los fabricantes o los distribuidores sólo podrán hacer
donativos de equipo o de materiales informativos o educativos a petición
y con la autorización escrita de la autoridad gubernamental competente
o ateniéndose a las orientaciones que los gobiernos hayan dado con esa
finalidad. Ese equipo o esos materiales pueden llevar el nombre o el símbolo
de la empresa donante, pero no deben referirse a ninguno de los productos comerciales
comprendidos en las disposiciones del Código Internacional de Comercialización
de Sucedáneos de la Leche Materna de la Organización Mundial de
la Salud y sólo se deben distribuir por conducto del sistema de atención
de salud.
e) El público en general y las madres
• No deben ser objeto de publicidad ni de ninguna otra forma de promoción
destinada al público en general los productos comprendidos en las disposiciones
del Código Internacional de Comercialización de Sucedáneos
de la Leche Materna de la Organización Mundial de la Salud.
• Los fabricantes y los distribuidores no deben facilitar, directa o indirectamente,
a las mujeres embarazadas, a las madres o a los miembros de sus familias, muestras
de los productos comprendidos en las disposiciones del Código Internacional
de Comercialización de Sucedáneos de la Leche Materna de la Organización
Mundial de la Salud.
• De conformidad con los párrafos anteriores no debe haber publicidad
en los puntos de venta, ni distribución de muestras ni cualquier otro
mecanismo de promoción que pueda contribuir a que los productos comprendidos
en las disposiciones del Código Internacional de Comercialización
de Sucedáneos de la Leche Materna de la Organización Mundial de
la Salud se vendan al consumidor directamente y al por menor, como serían
las presentaciones especiales, los cupones de descuento, las primas, las ventas
especiales, la oferta de artículos de reclamo, las ventas vinculadas,
etc. La disposición no debe restringir el establecimiento de políticas
y prácticas de precios destinadas a facilitar productos a bajo coste
y a largo plazo.
• Los fabricantes y distribuidores no deben distribuir a las mujeres embarazadas
o a las madres de lactantes y niños de corta edad obsequios de artículos
o utensilios que puedan fomentar la utilización de sucedáneos
de la leche materna o la alimentación con biberón.
• El personal de comercialización no debe tratar de tener, a título
profesional, ningún contacto, directo o indirecto, con las mujeres embarazadas
o con las madres de lactantes y niños de corta edad.
f) Empleados de los fabricantes y de los distribuidores
a. En los sistemas que aplican incentivos de ventas para el personal de comercialización,
el volumen de ventas de los productos comprendidos en las disposiciones del
Código Internacional de Comercialización de Sucedáneos
de la Leche Materna de la Organización Mundial de la Salud no debe incluirse
en el cómputo de las gratificaciones ni deben establecerse cuotas específicas
para la venta de dichos productos. Ello no debe interpretarse como un impedimento
para el pago de gratificaciones basadas en el conjunto de las ventas efectuadas
por una empresa de otros productos que ésta comercialice.
b. El personal empleado en la comercialización de productos comprendidos
en las disposiciones del Código Internacional de Comercialización
de Sucedáneos de la Leche Materna de la Organización Mundial de
la Salud no debe, en el ejercicio de su profesión, desempeñar
funciones educativas en relación con las mujeres embarazadas o las madres
de lactantes y niños de corta edad. Ello no debe interpretarse como un
impedimento para que dicho personal sea utilizado en otras funciones por el
sistema de atención de salud, a petición y con la aprobación
escrita de la autoridad competente del gobierno interesado.
g) Etiquetado
a. Las etiquetas deben concebirse para facilitar toda la información
indispensable acerca del uso adecuado del producto y de modo que no induzcan
a desistir de la lactancia natural.
b. Los fabricantes y distribuidores de las preparaciones para lactantes deben
velar por que se imprima en cada envase o un una etiqueta que no pueda despegarse
fácilmente del mismo una inscripción clara, visible y de lectura
y comprensión fáciles, en el idioma apropiado, que incluya todos
los puntos siguientes:
— las palabras "Aviso importante" o su equivalente;
— una afirmación de la superioridad de la lactancia natural;
— una indicación en la que conste que el producto sólo debe
utilizarse si un agente de salud lo considera necesario y previo asesoramiento
de éste acerca del modo apropiado de empleo;
— instrucciones para la preparación apropiada con indicación
de los riesgos que una preparación inapropiada puede acarrear para la
salud.
— Ni el envase ni la etiqueta deben llevar imágenes de lactantes
ni otras imágenes o textos que puedan idealizar la utilización
de las preparaciones para lactantes. Sin embargo, pueden presentar indicaciones
gráficas que faciliten la identificación del producto como un
sucedáneo de la leche materna y sirvan para ilustrar los métodos
de preparación. No deben utilizarse términos como "humanizado",
"materializado" o términos análogos. Pueden incluirse prospectos
con información suplementaria acerca del producto y su empleo adecuado,
a reserva de las condiciones antedichas, en cada paquete o unidad vendidos al
por menor. Cuando las etiquetas contienen instrucciones para modificar un producto
y convertirlo en una preparación para lactantes, son aplicables las disposiciones
precedentes.
c. Los productos alimentarios comprendidos en las disposiciones del Código
Internacional de Comercialización de Sucedáneos de la Leche Materna
de la Organización Mundial de la Salud y comercializados para la alimentación
de lactantes, que no reúnan todos los requisitos de una preparación
para lactantes, pero que puedan ser modificados a ese efecto, deben llevar en
el marbete un aviso en el que conste que el producto no modificado no debe ser
la única fuente de alimentación de un lactante. Puesto que la
leche condensada azucarada no es adecuada para la alimentación de los
lactantes ni debe utilizarse como principal ingrediente en las preparaciones
destinadas a éstos, las etiquetas correspondientes no deben contener
indicaciones que puedan interpretarse como instrucciones acerca de la manera
de modificar dicho producto con tal fin.
d. La etiqueta de los productos alimentarios comprendidos en las disposiciones
del Código Internacional de Comercialización de Sucedáneos
de la Leche Materna de la Organización Mundial de la Salud debe indicar
todos y cada uno de los extremos siguientes:
— los ingredientes utilizados;
— la composición/análisis del producto;
— las condiciones requeridas para su almacenamiento y
— el número de serie y la fecha límite para el consumo del
producto, habida cuenta de las condiciones climatológicas y de almacenamiento
en el país de que se trate.
h) Calidad
a. La calidad de los productos es un elemento esencial de la protección
de la salud de los lactantes y, por consiguiente, debe ser de un nivel manifiestamente
elevado.
b. Los productos alimentarios comprendidos en las disposiciones del Código
Internacional de Comercialización de Sucedáneos de la Leche Materna
de la Organización Mundial de la Salud y destinados a la venta o a cualquier
otra forma de distribución deben satisfacer las normas aplicables recomendadas
por la Comisión del Codex Alimentarius y las disposiciones del Codex
recogidas en el Código de Prácticas de Higiene para los Alimentos
de los Lactantes y los Niños.
i) Aplicación y vigilancia
i.1) Los gobiernos deben adoptar, habida cuenta de sus estructuras sociales
y legislativas, las medidas oportunas para dar efecto a los principios y al
objetivo del Código Internacional de Comercialización de Sucedáneos
de la Leche Materna de la Organización Mundial de la Salud, incluida
la adopción de leyes y reglamentos nacionales u otras medidas pertinentes.
A ese efecto, los gobiernos deben procurar obtener, cuando sea necesario, el
concurso de la OMS, del UNICEF y de otros organismos del sistema de las Naciones
Unidas. Las políticas y las medidas nacionales, en particular las leyes
y los reglamentos, que se adopten para dar efecto a los principios y al objetivo
del Código Internacional de Comercialización de Sucedáneos
de la Leche Materna de la Organización Mundial de la Salud, deben hacerse
públicas y deben aplicarse sobre idénticas bases a cuantos participen
en la fabricación y la comercialización de productos comprendidos
en las disposiciones del Código Internacional de Comercialización
de Sucedáneos de la Leche Materna de la Organización Mundial de
la Salud.
i.2) La vigilancia de la aplicación Código Internacional de Comercialización
de Sucedáneos de la Leche Materna de la Organización Mundial de
la Salud corresponde a los gobiernos actuando tanto individualmente como colectivamente
por conducto de la Organización Mundial de la Salud, a tenor de lo previsto
en los párrafos i.6 e i.7. Los fabricantes y distribuidores de los productos
comprendidos en las disposiciones del Código Internacional de Comercialización
de Sucedáneos de la Leche Materna de la Organización Mundial de
la Salud, así como las organizaciones no gubernamentales, los grupos
de profesionales y las asociaciones de consumidores apropiados deben colaborar
con los gobiernos con ese fin.
i.3) Independientemente de cualquier otra medida adoptada para la aplicación
del Código Internacional de Comercialización de Sucedáneos
de la Leche Materna de la Organización Mundial de la Salud, los fabricantes
y los distribuidores de productos comprendidos en las disposiciones del mismo
deben considerarse obligados a vigilar sus prácticas de comercialización
de conformidad con los principios y el objetivo del Código Internacional
de Comercialización de Sucedáneos de la Leche Materna de la Organización
Mundial de la Salud y a adoptar medidas para asegurar que su conducta en todos
los planos resulte conforme a dichos principios y objetivo.
i.4) Las organizaciones no gubernamentales, los grupos profesionales, las instituciones
y los individuos interesados deben considerarse obligados a señalar a
la atención de los fabricantes o distribuidores las actividades que sean
incompatibles con los principios y el objetivo del Código Internacional
de Comercialización de Sucedáneos de la Leche Materna de la Organización
Mundial de la Salud, con el fin de que puedan adaptarse las medidas oportunas.
Debe informarse igualmente a la autoridad gubernamental competente.
i.5) Los fabricantes y distribuidores primarios de productos comprendidos en
las disposiciones del Código Internacional de Comercialización
de Sucedáneos de la Leche Materna de la Organización Mundial de
la Salud deben informar a todos los miembros de su personal de comercialización
acerca de las disposiciones del Código Internacional de Comercialización
de Sucedáneos de la Leche Materna de la Organización Mundial de
la Salud y de las responsabilidades que les incumben en consecuencia.
i.6) De conformidad con lo dispuesto en el Artículo 62 de la Constitución
de la Organización Mundial de la Salud, los Estados Miembros informarán
anualmente al Director General acerca de las medidas adoptadas para dar efecto
a los principios y al objetivo del Código Internacional de Comercialización
de Sucedáneos de la Leche Materna de la Organización Mundial de
la Salud.
i.7) El Director General informará todos los años pares a la Asamblea
Mundial de la Salud acerca de la situación en lo que se refiere a la
aplicación de las disposiciones del Código Internacional de Comercialización
de Sucedáneos de la Leche Materna de la Organización Mundial de
la Salud; y prestará asistencia técnica, a los Estados Miembros
que la soliciten, para la preparación de leyes o reglamentos nacionales
o para la adopción de otras medidas apropiadas para la aplicación
y la promoción de los principios y el objetivo del Código Internacional
de Comercialización de Sucedáneos de la Leche Materna de la Organización
Mundial de la Salud.
Art 1360 - (Res 1505, 10.08.88) Sin reglamentar
Art 1361 - (Res 1505, 10.08.88) Sin reglamentar
Art 1362 - (Res 1505, 10.08.88) Sin reglamentar
ALIMENTOS FORTIFICADOS
Art 1363 - (Res. Con. 118/2008 SPReI y 474/2008 SAGPyA) - Se entiende por Alimentos Fortificados aquellos alimentos en los cuales la proporción de proteínas y/o aminoácidos y/o vitaminas y/o substancias minerales y/o ácidos grasos esenciales es superior a la del contenido natural medio del alimento corriente, por haber sido suplementado significativamente.
La porción del alimento fortificado deberá aportar entre un:
1. 20% y 50% para vitaminas liposolubles y minerales
2. 20% y 100% para vitaminas hidrosolubles
de los Requerimientos Diarios Recomendados establecidos en las Tablas del anexo A de la Resolución Conjunta 149-2005 SPRRS y 683-2005 SAGPyA: Valores Diarios de Referencia de nutrientes (VDR) de declaración obligatoria y Valores de Ingesta Diaria Recomendada de nutrientes (IDR) de declaración voluntaria: vitaminas y minerales o algunas de las tablas mencionadas en el Art. 1367 cuando se trate de un alimento para grupos poblacionales específicos no contemplados por la Res. GMC 46/03.
Los nutrientes incorporados deberán:
a) Ser estables en el alimento en las condiciones habituales de almacenamiento, distribución, expendio y consumo y presentar una adecuada biodisponibilidad.
b) No presentar incompatibilidad con ninguno de los componentes del alimento ni con otro nutriente agregado.
c) Estar presente en niveles tales que no ocasionen una ingesta excesiva por efecto acumulativo a partir de otras fuentes de la dieta.
No se autorizará la fortificación de las siguientes clases de alimentos: cárneos y productos derivados, helados, alimentos azucarados —Capítulo X— (excepto los que contengan jugo en su composición), bebidas analcohólicas o polvos para prepararlas (excepto en ambos casos que contengan jugo en su composición), aguas, aguas carbonatadas, aguas minerales, con o sin gas.
La denominación de venta de los alimentos fortificados será "…fortificado(a) con…". En el primer espacio en blanco se indicará la denominación de venta del alimento correspondiente sin fortificar y en el segundo espacio en blanco el (los) nutriente(s) con que se ha fortificado el alimento. En la tabla de información nutricional o debajo de ella se indicará la ingesta diaria recomendada del alimento, el grupo etario que se adoptó como referencia y el porcentaje de la ingesta diaria recomendada del (de los) nutriente(s) que cubre la ingesta recomendada del alimento.
Art 1363 bis - (Res MSyAS N° 074 del 5.02.98) Derogado.
Art 1363 tris - (Res MSyAS N° 074 del 5.02.98) Derogado.
Art 1364 - (Res 1505, 10.08.88) "Los alimentos fortificados con proteínas deberán responder a las siguientes exigencias:
a) Su contenido en proteínas será por lo menos el doble del que contienen los alimentos comunes correspondientes. En ningún caso podrá ser menor del 20% p/p del producto.
b) La relación entre el valor calórico de las proteínas y el valor calórico del producto será igual o superior a 0,2.
c) El valor biológico de las proteínas del alimento fortificado no será menor del 60% y su digestibilidad verdadera no será menor del 80%.
d) Podrán ser adicionados de vitaminas y/o minerales, siempre que se cumplan las exigencias establecidas para los Alimentos Dietéticos Fortificados con Vitaminas y/o Minerales.
Estos alimentos se rotularán con la denominación del producto de que se trate seguido de la indicación Fortificado con Proteínas. Deberán ser consignados todos los requisitos de rotulación insertos en el Artículo 1345, la indicación del requerimiento normal (FAO/OMS/UNU) y el porcentaje del mismo que cubre la ingesta diaria recomendada del alimento y la designación específica de la materia proteínica empleada en la fortificación".
Art 1365 - (Res 1505, 10.08.88) "Los derivados proteínicos utilizados para fortificar alimentos podrán ser de origen vegetal o animal o bien mezcla de ambos tipos. Estos derivados deberán responder a las siguientes condiciones:
a) Los de origen vegetal exhibirán como mínimo 35% de contenido proteínico sobre base seca.
b) Los de origen animal exhibirán como mínimo 60% de contenido proteínico sobre base seca.
c) El contenido de agua a 100-105°C en ambos tipos no excederá de 8%.
d) El valor biológico de las proteínas de dichos productos no será inferior a 60% y su digestibilidad verdadera no será menor del 80%.
e) El contenido de ácido nucleico será menor del 2%".
Art 1366 - (Res 1505, 10.08.88) "Para la autorización de alimentos dietéticos fortificados con proteínas, así como de los productos proteínicos utilizados para su fortificación, deberá presentarse como condición previa la siguiente información:
a) Materias primas
b) Composición química
c) Contenido porcentual en aminoácidos esenciales
d) Digestibilidad en animales de experimentación (D).
e) Relación de Eficiencia Proteínica (PER) o Utilización Proteínica Neta (UPN).
f) Valor biológico: UPN/D
g) Ensayos de estabilidad
h) Examen bacteriológico".
Art 1367 - (Res 1505, 10.08.88) "Los alimentos fortificados con aminoácidos esenciales deberán responder a las siguientes exigencias:
a) Sólo podrán ser empleados los siguientes aminoácidos esenciales que deberán responder a las exigencias del presente Código:
DL-metionina o
L-cistina FCC
L-creonina FCC
L-fenilalanina FCC
L-histidina FCC
L-isoleucina FCC
L-leucina FCC
L-lisina monoclorhidrato FCC
L-metionina FCC
L-tirosina FCC
L-triptofano FCC
L-valina FCC
TABLA: REQUERIMIENTOS ESTIMADOS DE AMINOACIDOS A DIFERENTES EDADES FAO/WHO/UNU.
Serie de Informes Técnicos Nº 724 (1985) Pág 65.
| Aminoácido |
Niños 2-4 años |
Escolares 10-12 años |
Adultos |
|
|
(Miligramos por kilogramo por día) |
||||
|
Histidina |
|
|
8 - 12 |
|
|
Isoleucina |
31 |
30 - 31 |
10 |
|
|
Leucina |
73 |
44 - 45 |
14 |
|
|
Lisina |
64 |
60 - 64 |
12 |
|
|
Metionina+Cistina |
27 |
22 - 27 |
13 |
|
|
Fenilalanina+Tirosina |
69 |
22 - 27 |
14 |
|
|
Treonina |
37 |
28 - 35 |
7 |
|
|
Triptofano |
12,5 |
3,3- 4 |
3,5 |
|
|
Valina |
38 |
25 - 33 |
10 |
|
b) Las cantidades agregadas no deben hacer superior a 100, el índice químico de la fracción proteica de los alimentos fortificados en proteínas y/o aminoácidos.
El índice químico de una proteína es el resultado obtenido al multiplicar por 100 el cociente más pequeño obtenido al dividir la cantidad de cada uno de los aminoácidos esenciales o grupo de aminoácidos esenciales presente en 100g de esa proteína, por la correspondiente cantidad presente en 100g de la proteína de referencia.
La proteína de referencia se caracteriza por los tenores siguientes, referidos a 100g (FAO/OMS/UNU. Serie de Informes Técnicos Nº 724 (1985) Pág. 121):
|
DL-metionina+L-cistina |
2,5g |
|
L-fenilalanina+L-tirosina |
6,3g |
|
L-histidina |
1,9g |
|
L-isoleucina |
2,8g |
|
L-leucina |
6,6g |
|
L-lisina |
5,8g |
|
L-treonina |
3,4g |
|
L-triptofano |
1,1g |
|
L-valina |
3,5g |
El valor biológico de las proteínas del alimento fortificado con aminoácidos no será menor del 60% y su digestibilidad verdadera no será menor del 80%.
Los alimentos se rotularán con la denominación del producto de que se trata seguido de la indicación Fortificado con Aminoácidos Esenciales. Deberán consignar todos los requisitos de rotulación insertos en el Artículo 1345 y listado cuali-cuantitativo de los aminoácidos agregados".
Art 1368 - (Res 1505, 10.08.88) "Las leches fluidas fortificadas con Vitaminas A ó D o A y D (enteras, descremadas, parcialmente descremadas) resultantes de la adición a la leche de los preparados vitamínicos correspondientes, deberán contener:
a) Vitamina A: no más de 2500 U.I. por litro
b) Vitamina D: no más de 400 U.I. por litro
Las leches en polvo enteras, descremadas o parcialmente descremadas fortificadas deberán ser adicionadas con cantidades tales de esos preparados vitamínicos que una vez reconstituidas cumplan con las mismas exigencias impuestas al respecto para las leches fluidas.
Estos productos se rotularán con la denominación del producto de que se trate seguido de la indicación Fortificada con Vitamina A o Fortificada con Vitamina D o Fortificada con Vitaminas A y D, según corresponda. Deberán consignar todos los requisitos de rotulación insertos en el Artículo 1345.
La indicación del requerimiento diario y el por ciento del mismo que cubre la ingesta diaria del alimento (1364).
ALIMENTOS ENRIQUECIDOS
Art 1369 - (Res 1505, 10.08.88) "Se entiende por Alimentos Enriquecidos aquellos a los que se han adicionado nutrientes esenciales (Vitaminas y/o minerales y/o proteínas y/o aminoácidos esenciales y/o ácidos grasos esenciales) con el objeto de resolver deficiencias de la alimentación que se traducen en fenómenos de carencia colectiva.
La elaboración y expendio de dichos alimentos será permitida cuando:
a) La autoridad sanitaria competente determine las adiciones necesarias y sus concentraciones, los tipos de alimentos sobre los que se podrán efectuar, las exigencias de rotulación, las características del expendio y el alcance del mismo.
b) Se haya probado que las deficiencias de alimentación no pueden ser corregidas en forma económica con alimentos normales o corrientes.
c) Las carencias deberán ser establecidas por la comunidad científica que identificará el problema, los grupos poblacionales afectados y la magnitud del alcance (regional, multiregional o nacional)".
ALIMENTOS MODIFICADOS EN SU VALOR ENERGETICO
Art 1370 - (Res 1542, 12.09.90)
"a) Con la designación de Alimentos Dietéticos de Valor Energético o Calórico Reducido se entiende a los alimentos que proveen una cantidad de energía no superior al 70% de la que provee el alimento corriente correspondiente.
Un alimento de valor energético o calórico reducido no debe ser nutricionalmente inferior al alimento corriente, excepción hecha del contenido energético.
A estos efectos se considera que la inferioridad nutricional incluye cualquier reducción en el contenido de un nutriente esencial que se encuentre presente en una cantidad medible, pero no incluye la reducción en el contenido de hidratos de carbono y/o lípidos.
Se entiende por una cantidad medible de un nutriente esencial (proteína, vitamina, ácido graso poliinsaturado o mineral) presente en 100g o 100 cm3 en una cantidad especificada del alimento tal como se lo consume corrientemente, al 2% de la ingesta diaria recomendada de ese nutriente esencial.
Se admite el uso de edulcorantes no nutritivos según las siguientes condiciones:
Aspartamo: hasta 500 mg/100g ó 100 cm3 en el alimento listo para consumir y hasta 1000 mg/100g para goma de mascar.
Sacarina: 20 mg/100g ó 100 cm3 en el alimento listo para consumir.
Ciclamato: 100 mg/100g ó 100 cm3 en el alimento listo para consumir.
No se admite la elaboración de bebidas analcohólicas de contenido energético reducido.
b) Con la designación de Alimentos Dietéticos de Bajas Calorías (exceptuando bebidas) se entiende a los alimentos que proveen un máximo de 40 kcal por porción recomendada lista para consumir y que tengan una densidad energética no mayor de 40 kcal por 100g ó 100 cm3 del alimento listo para consumir.
No deben ser nutricionalmente inferiores al alimento corriente que sustituyen, como se indica en a). Se admite el uso de los edulcorantes no nutritivos según las condiciones de uso indicadas en a).
c) (Res 762, 16.11.94) "Con la designación de Bebidas sin Alcohol Dietéticas de Bajas Calorías o Bebidas sin Alcohol Dietéticas, se entiende a la bebida que provee como máximo 20 Kcal/100 cm3".
Se admite el uso de edulcorantes no nutritivos según la siguientes condiciones de uso:
Aspartamo máx: 100 mg/100 cm3;
Sacarina máx: 15 mg/100 cm3;
Ciclamato máx: 100 mg/100 cm3
En los productos para preparar bebidas por dilución, se admite como máximo la concentración de edulcorantes no nutritivos que resulta de multiplicar el máximo permitido en la bebida lista para el consumo por la dilución a efectuar y por el factor 0,75.
En los productos para preparar alimentos y bebidas mediante la incorporación de otros ingredientes se deberá considerar la concentración de edulcorantes no nutritivos y el cálculo en kcal en el alimento o bebida listos para consumir.
Los alimentos consignados en los Incs a), b) y c) se rotularán con la denominación del producto de que se trata y la indicación Reducido en Calorías ó De Bajas Calorías según corresponda. Deberán consignar todos los requisitos de rotulación del Artículo 1345.
Si contienen edulcorantes no nutritivos deberá incluirse:
1) La declaración cuali-cuantitativa de los edulcorantes no nutritivos en mg/100g ó 100 cm3, con caracteres no menores de 1,5 mm de altura.
Podrán indicarse las kcal ahorradas frente a igual ingesta de alimento corriente correspondiente así como llevar las indicaciones Para Dietas Restringidas en Calorías y Consulte a su Médico.
Los alimentos corrientes que cumplan con los requisitos energéticos que se exigen a los alimentos dietéticos de bajas calorías (Inc b) podrán llevar la leyenda El/La..., Es Un Alimento De Bajas Calorías, llenando el espacio en blanco con la denominación del alimento".
ALIMENTOS MODIFICADOS EN SU COMPOSICION GLUCIDICA
Art 1371 - (Res 1505 del 10.08.88) "Con la designación de Alimentos Dietéticos de Bajo Valor Glucídico se entiende los que presentan una disminución con respecto a los alimentos corrientes correspondientes, de los contenidos de los siguientes carbohidratos asimilables:
Mono-, Di-, Oligo- y Polisacáridos,
de acuerdo al siguiente esquema:
a) Alimentos amiláceos (pan, pastas, harinas, productos de panadería y pastelería y otros similares): deberán presentar una reducción no menor del 30% p/p del contenido normal de carbohidratos asimilables en el producto listo para consumir.
b) Mermeladas, compotas, jaleas, conservas de frutas, néctares, postres y otros productos similares: no deben contener más del 10% p/p de carbohidratos asimilables en el producto listo para consumir.
c) Otros alimentos: deberán presentar una reducción no menor del 50% p/p del contenido normal de carbohidratos asimilables en el producto listo para consumir.
d) (Res 1542 del 12.09.90), Derogado
Podrán emplearse los siguientes edulcorantes nutritivos: Sorbitol y Xilitol y los edulcorantes no nutritivos autorizados: Aspartamo, Sacarina y Ciclamato con las restricciones de uso consignadas en el Artículo 1364".
(Res 101 del 22.02.93, Artículo 10, "Reemplácese el párrafo del Artículo 1371 que establece:
"Podrán emplearse los siguientes edulcorantes no nutritivos autorizados: Aspartamo, Sacarina y Ciclamato con las restricciones de uso consignadas en el Artículo 1364",
por el siguiente que quedará redactado de la siguiente forma:
"Podrán emplearse Polidextrosa y Polidextrosa K para la elaboración de:
Aderezos para Ensaladas,
Budines y Rellenos,
Caramelos Duros y Blandos,
Confituras y Merengues,
Gelatinas,
Gomas de Mascar,
Helados,
Mezclas para Hornear,
Mezclas y Postres Lácteos,
Productos horneados,
no fijándose límite para su empleo quedando regulado por las buenas prácticas de manufactura.
Cuando se utilice para Productos Dietéticos, si la porción simple comestible contiene más de 15 g de Polidextrosa o Polidextrosa K, el rótulo deberá indicar:
"Individuos sensibles pueden experimentar un efecto laxativo por consumo excesivo de este producto" o frase similar. Asimismo pueden utilizarse los siguientes edulcorantes nutritivos: Sorbitol, Xilitol y Jarabe de Maltitol quedando regulado su empleo por las buenas prácticas de manufactura.
Puede utilizarse Manitol con las siguientes limitaciones:
Podrán emplearse también los edulcorantes no nutritivos autorizados por el presente Código: Aspartamo, Sacarina; Ciclamato, Esteviósido, Neohesperidina dihidrochalcona y Acesulfame K con las restricciones establecidas".
(Res 1505 del 10.08.88) "El contenido de lípidos no deberá ser superior al de los alimentos comparables de consumo corriente.
Estos alimentos se rotularán con la denominación del producto de que se trate seguida de la indicación Alimento Dietético de Contenido Glucídico Reducido ó De Bajo Valor Glucídico.
Si paralelamente cumplen con los requisitos de los alimentos reducidos en su valor energético (Artículo 1370) podrán llevar además las leyendas Reducido en Calorías ó Bajas Calorías.
Deberán consignar todos los requisitos de rotulación indicados en el Artículo 1345. Si contiene edulcorantes no nutritivos debe consignar además las indicaciones del Artículo 1349.
Los polialcoholes y los edulcorantes no nutritivos serán indicados por sus nombres específicos.
Además se incluirá la siguiente información nutricional:
1) El contenido total combinado de carbohidratos asimilables (Mono-, Di-, Oligo- y Polisacáridos, así como polialcoholes).
2) El contenido total combinado de Mono-, Di-, Oligosacáridos y polialcoholes.
3) El contenido de polialcoholes (sorbitol y xilitol), expresado en gramos por 100g ó 100 cm3 de alimento, según corresponda, tal como se consume; adicionalmente podrá indicarse por cantidad especificada de alimento sugerida para el consumo".
(Res 1542 del 12.09.90) "Deroga anteúltimo párrafo de este Artículo 1371".
(Res 1505 del 10.08.88) "El producto deberá llevar la indicación del valor energético con caracteres de buen realce y visibilidad y altura no menor de 2 mm".
Art 1372 - (Res 1505, 10.08.88) "Con la designación de Alimento de Contenido Bajo en Lactosa y de Alimento de Contenido Reducido en Lactosa se entiende aquellos alimentos cuyo valor dietario especial resulta de la restricción de los ingredientes que contienen lactosa, la separación de la lactosa del alimento, la descomposición de la lactosa o una combinación de estos métodos.
El alimento de bajo contenido de lactosa no contendrá más de 5% de la proporción de lactosa del alimento corriente correspondiente.
El alimento de contenido reducido de lactosa no contendrá más del 30% de la proporción del alimento corriente correspondiente.
Para la preparación de leche de bajo contenido de lactosa se podrá emplear ß-galactosidasa en la proporción necesaria para hidrolizar la lactosa de la leche.
Estos alimentos se rotularán con la denominación del producto de que se trate seguida de la indicación Bajo en Lactosa ó Reducido en Lactosa y los requisitos de rotulación del Artículo 1345. Además deberán llevar la indicación del porcentaje de reducción del contenido de lactosa (95% ó 70%) según corresponda y del contenido de lactosa y galactosa expresado en miligramos por 100g ó 100 ml".
ALIMENTOS MODIFICADOS EN SU COMPOSICION PROTEICA
Art 1373 - (Res 1505, 10.08.88) "Se entiende por Productos de Alto Contenido en Gluten (pan, fideos, bizcochos y otros) los elaborados con harinas disminuidas en su contenido en almidón ya sea por extracción de éste o por el agregado únicamente de gluten en polvo.
No podrán ser adicionados de proteínas extrañas al gluten. Su contenido proteico será como mínimo del 20% del producto seco".
Art 1374 - (Res 1505, 10.08.88) "Se entiende por Harina o Polvo de Gluten al producto desecado y pulverizado que se obtiene después de la eliminación de la casi totalidad del almidón de las harinas que lo contienen (trigo, centeno, etc.).
Deberá contener como máximo 12% de almidón y 10% de humedad a 100-105°C".
Art 1375 - (Res 1505, 10.08.88) Sin reglamentar.
ALIMENTOS MODIFICADOS EN SU COMPOSICION LIPIDICA
Art 1376 - (Res Conjunta 13/2005 y 85/2005) Con la designación de Alimentos Dietéticos de Contenido Lipídico Reducido se entienden aquellos que contienen como máximo el 50% del contenido lipídico de los alimentos corrientes correspondientes, listos para el consumo.
Esta reducción no podrá ser obtenida por la adición al producto de hidrocarburos.
No deberán ser nutricionalmente inferiores de acuerdo al Artículo 1370 Inc. a).
Podrán ser adicionados de:
Vitamina A: 1000 a 6000 U.I./100g.
Beta Caroteno
Acido Sórbico y sus Sales de Sodio, Potasio y Calcio: máx. 1g/kg (como ácido).
Mono y Diglicéridos de Acidos Grasos
Lecitina
Espesantes-Estabilizantes
Caseinatos de Sodio, Potasio y Calcio y/u otras proteínas lácteas.
Se admite el uso de olestra (octa, hepta, hexa ésteres de ácidos
grasos de cadena larga con sacarosa) en productos de copetín
(snacks) salados o picantes pero no dulces.
En estos alimentos se podrá utilizar olestra en reemplazo de grasas
y aceites para freír u hornear, como acondicionador de
masa, en sprays, como ingrediente de rellenos o en aromatizantes-saborizantes.
En el caso de utilizar olestra deberán ser
incorporadas las siguientes Vitaminas: 1,9 mg de Alfatocoferol, 51 eq Retinol
(como Acetato o Palmitato de Retinol); 12 UI
Vitamina D y 8 microgramos de Vitamina K, por gramo de olestra.
El olestra deberá cumplir con las siguientes exigencias:
| Contenido libre de ácidos grasos | Máx. 0,5 %, |
| Residuo de ignición | Máx. 0,5 % |
| Total de metales pesados | Máx. 10 ppm |
| Plomo | Máx. 0,1 ppm |
| Total de metanol disponible | Máx. 300 ppm |
| Agua | Máx. 0,1 % |
| Indice de peróxidos | Máx. 10 meq de oxígeno/kg |
Se admite el uso de salatrim (triacilglicéridos de ácidos grasos de cadena corta y larga) como sustituto de grasas y aceites.
Se denomina salatrim (acrónimo en inglés de triacilglicéridos
de ácidos grasos de cadena corta y larga) al producto constituido
por una mezcla de triglicéridos que contienen grupos acilo de cadena
corta (C2 a C4 (acetato, propionato, butirato)) y grupos
acilo de cadena larga (predominantemente C16 y C18 (palmitato y estearato))
que se obtiene por la interesterificación no
enzimática de triglicéridos de grupos acilo de cadena corta (ACC:
triacetina, tripropionina, tributirina o sus mezclas) con
triglicéridos de grupos acilo de cadena larga (ACL: aceite de soja, algodón,
girasol o canola), resultando una mezcla de
triglicéridos que contienen uno o dos grupos ACC y uno o dos grupos ACL.
La energía disponible o asimilable del salatrim es aproximadamente 5 kcal/g.
El salatrim deberá cumplir las siguientes especificaciones:
| Triglicéridos | Mín 87% |
| Triglicéridos con relación molar ACC/ACL entre 0,5 y 2,0 | Mín. 90% |
| ACL saturados | Máx. 70% |
| Agua (Método de Karl Fischer) | Máx. 0,3% |
| Cenizas sulfatadas | Máx. 0,1% |
| Acidos grasos libres (como oleico) | Máx. 0,5% |
| Monoglicéridos | Máx. 2% |
| Indice de Peróxidos | Máx. 2% meq de
oxígeno/kg |
| Materia insaponificable | Máx. 1% |
| Punto de Fusión (según la composición de triglicéridos) | De 16 a 71°C |
| Plomo | Máx. 0,1mg/kg |
Para declarar la cantidad de salatrim se utilizará alguna de las técnicas
citadas en el artículo 1414 del presente Código:
- Huang A.S., Robinson L.R., Pelluso R.A., Gursky L.G., Pidel A., Manz A.,
Softly B.J., Templeman G.J., Finley J.W. and
Leveille G.A. Quantification of Generic Salatrim in Foods Containing Salatrim
and Other Fats Having Medium and Long Chain
Fatty Acid J. Agric. Food Chem. 1997,45, 1770-1778
- Huang A.S., Robinson L.R., Gursky L.G., Profita R. and Sabidong C.G. Identification
and Quantification of Salatrim 23CA
in Foods by the Combination of Supercritical Fluid Extraction, Particle Beam
LC-Mass Spectrometry, and HPLC with
Light-Scattering Detector J. Agric. Food Chem. 1994,42, 468-473
- Huang A.S., Robinson L.R., Gursky L.G., Pidel A., Delano G., Softly B.J.,
Templeman G.J., Finley J.W. and Leveille G.A.
Quantification of Generic Salatrim in Foods by the Combination of Nontraditional
Crude Fat Extraction and Short Nonpolar
Column High-Temperature Capillary Gas Chromatography. J. Agric. Food Chem. 1995,43,
1834-1844
Para determinar la cantidad de grasa total libre de salatrim se restará
el contenido de salatrim cuantificado por alguna de las
técnicas citadas en el artículo 1414 del presente Código,
al contenido de grasa total determinado por la técnica de la AOAC.
Cuando se declare la cantidad del(de los) tipo(s) de grasa(s) y/o ácidos
grasos y/o de colesterol y/o salatrim, esta declaración
seguirá inmediatamente a la de la cantidad de grasas totales, de la siguiente
manera:
grasas totales: ......................................... g, de las cuales:
grasas saturadas: .......................... g
grasas trans: ..................................g
grasas monoinsaturadas: ...............g
grasas poliinsaturadas: .................g
colesterol: ..................................mg
salatrim:........................................g
La cantidad de energía a declarar se deberá calcular utilizando los siguientes factores de conversión:
- Grasas libres de salatrim 9 kcal/g - 37kJ/g
- Salatrim 5 kcal/g - 20.5kJ/g
Los alimentos de bajo contenido lipídico se rotularán con la
denominación del producto de que se trate y con la indicación
"dietético, reducido en valor lipídico" o "dietético,
de contenido graso reducido" consignando las exigencias de rotulación
del
Artículo 1345. Si paralelamente cumple con los requisitos de los alimentos
reducidos en su valor energético (Artículo 1370)
podrán llevar las leyendas "reducido en calorías o bajas
calorías".
Como excepción, en el caso de alimentos corrientes de alto contenido
graso para los que el presente Código ha establecido un
contenido mínimo de materia grasa del 70%, se admitirá una reducción
del contenido lipídico de como mínimo el 30% para
considerarlos como pertenecientes a esta categoría.
En la rotulación de un alimento que contenga olestra deberá consignarse:
"Este producto contiene olestra. El olestra puede
causar malestar abdominal y flojedad en las deposiciones. Disminuye la absorción
de vitaminas A, D, E y K."
Deberán cumplir con las exigencias generales de rotulación.
Las mencionadas leyendas deberán figurar en letras de buen tamaño, realce y visibilidad.
Estos productos no se podrán considerar Alimentos fortificados."
Art 1377 - (Res 1505, 10.08.88) "Con la designación de Alimentos Dietéticos con Tenor Garantido en Triglicéridos de Cadena Mediana se entienden los alimentos que contienen una cantidad de triglicéridos de cadena mediana como mínimo del 90% del tenor total de lípidos; este porcentaje podrá ser reducido al 80% en el caso de que el producto contenga una cantidad total de ácido linoleico, linolénico y araquidónico superior o igual al 10% del tenor total de ácidos grasos.
Por triglicéridos de cadena mediana se entienden los triglicéridos que contienen en su molécula ácidos grasos de 8, 10 ó 12 átomos de carbono. Podrán ser adicionados de los aditivos mencionados en el Artículo 1376.
Estos productos se rotularán de acuerdo a las exigencias del Artículo 1345 con la indicación Tenor Garantido en Triglicéridos de Cadena Mediana. Deberán consignar el contenido porcentual de triglicéridos de cadena mediana".
Art 1378 - (Res 1505, 10.08.88) "Con la designación de Grasa Dietética con Tenor Garantido en Acidos Grasos Esenciales se entiende la grasa alimenticia concreta, de punto de fusión como mínimo de 20°C, que contiene por lo menos el 50% de ácidos linoleico y araquidónico referidos al total de ácidos grasos. Deberán contener como mínimo 1 mg de vitamina E por gramo de ácidos grasos esenciales.
Podrán ser adicionados de los aditivos mencionados en el Artículo 1376 a excepción de los caseinatos de sodio, potasio y calcio. Este producto se rotulará de acuerdo con las exigencias del Artículo 1345 con la indicación Tenor Garantido de Acidos Grasos Esenciales. Deberá consignar el contenido de ácidos grasos esenciales expresado en gramos por 100 gramos del producto".
Art 1378 bis - (Res 305 del 26.03.93) - "Con la designación de Alimento dietético sin Colesterol se entiende a aquellos que normalmente lo contienen pero que han sido elaborados sólo con materias primas que no aporten colesterol o los que mediante un adecuado proceso tecnológico logren eliminar totalmente el colesterol de su composición normal.
Estos alimentos se rotularán con la denominación específica del producto original y la indicación "Sin Colesterol" próxima a la misma.
Si paralelamente cumplen otros requisitos de un alimento reducido en tenor graso y/o de un alimento reducido en calorías, en la rotulación deberán consignar los requisitos del Artículo 1345 del presente Código".
ALIMENTOS MODIFICADOS EN SU COMPOSICION MINERAL
Art 1379 - (Res 1505, 10.08.88) "Se entiende por Alimento de Bajo Contenido en Sodio aquellos en los cuales se ha reducido sensiblemente su contenido, constituyendo un medio para regular la ingesta de sodio.
Se clasifican en:
Estos alimentos se rotularán con la denominación del producto de que se trate seguido de la indicación Bajo en Sodio ó Muy Bajo en Sodio según corresponda. Deberán consignar todos los requisitos de rotulación insertos en el Artículo 1345 y el contenido de sodio en miligramos por 100g de producto terminado. Deberá declararse la adición de sal dietética baja en sodio (Artículo 1380) y cuando se trate de una mezcla salina compuesta total o parcialmente por sales de potasio deberá indicarse el contenido total de potasio en 100 g de alimento listo para consumir.
Art 1380 - (Res 1505, 10.08.88) "Con la denominación de Sal Dietética Baja en Sodio se entienden las mezclas salinas, que por su sabor (sin aditivos aromatizantes) sean semejantes a la sal de mesa (cloruro de sodio). Podrán ser adicionadas de substancias antiaglutinantes y/o sápido aromáticas.
Podrán ser constituidas por sales amónicas, potásicas, cálcicas, magnésicas de los ácidos sulfúrico, adípico, glutámico, carbónico, láctico, clorhídrico, tartárico, acético, fosfórico, cítrico o sus mezclas.
Podrán ser adicionadas de:
a) Acidos: cítrico, tartárico, glutámico, adípico o sus mezclas.
b) Sales de colina de los ácidos: acético, carbónico, láctico, clorhídrico, tartárico, cítrico.
c) Antiaglutinantes: silicato de calcio, silicato de magnesio, carbonato de magnesio, fosfato tricálcico, aisladamente o en mezclas en no más del 2,0%. Los antiaglutinantes mencionados precedentemente podrán ser reemplazados por no más del 1,5% de sílice (dióxido de silicio, sílica aerogel).
d) Aceites esenciales y/o esencias artificiales en no más del 1,0%.
e) Apio, orégano, cebolla, ajo y/u otros vegetales permitidos, deshidratados y finamente molidos, en cantidad no mayor del 15,0%.
Las sales dietéticas bajas en sodio no deberán contener cantidades superiores a:
1) 3,0% p/p de colina en el producto.
2) 4,0% p/p de fósforo en el producto.
3) 20,0% p/p de magnesio, de la suma de cationes potasio, calcio y amonio.
4) 4,0% p/p de amonio en el producto.
5) 120 mg de sodio por 100 g de producto.
Deberán consignar todos los requisitos de rotulación insertos en el Artículo 1345 y las siguientes exigencias:
Llevarán en el cuerpo del envase con caracteres de igual tamaño, realce y visibilidad la denominación: Sal Dietética Baja en Sodio.
Si se hubiere elaborado con la adición de apio, orégano, cebolla, ajo y/u otros deberá rotularse Sal Dietética Baja en Sodio Con ... (llenando el espacio en blanco con el nombre común de la substancia agregada).
Si se hubiera elaborado con esencias naturales y/o sintéticas deberá rotularse Sal dietética Baja en Sodio con Esencia de ... (llenando el espacio en blanco con el nombre de la esencia si fuere natural). Si la esencia fuera artificial o una mezcla de esencias naturales y artificiales se rotulará Sal Dietética Baja en Sodio con Esencia Imitación a ... (llenando el espacio en blanco con el nombre de la esencia o esencias que imitan).
En todos los casos, se consignará en el rótulo, con caracteres y en lugar bien visible el contenido porcentual de aniones y cationes, así como la declaración cuali-cuantitativa del o de los antiaglutinantes.
Por debajo de la denominación del producto y con caracteres de buen tamaño, realce y visibilidad, deberá figurar la leyenda Para su Uso, Consulte al Médico".
Art 1381 - (Res. Con. 118/2008 SPReI y 474/2008 SAGPyA) - Suplementos Dietarios
1- Incorpórense los Suplementos Dietarios al Registro Nacional Unico (R.N.U.) de Productos, en el que quedarán registradas las autorizaciones de comercialización de tales productos otorgadas por la autoridad competente. Establécese que sólo se inscribirán en el Registro Nacional Unico (R.N.U.) de Productos, los Suplementos Dietarios que respondan a la definición establecida en el punto 2 del presente artículo.
2- Se definen como Suplementos Dietarios a los productos destinados a incrementar la ingesta dietaria habitual, suplementando la incorporación de nutrientes en la dieta de las personas sanas que, no encontrándose en condiciones patológicas, presenten necesidades básicas dietarias no satisfechas o mayores a las habituales. Siendo su administración por vía oral, deben presentarse en formas sólidas (comprimidos, cápsulas, granulado, polvos u otras) o líquidas (gotas, solución, u otras), u otras formas para absorción gastrointestinal, contenidas en envases que garanticen la calidad y estabilidad de los productos.
Podrán contener en forma simple o combinada: péptidos, proteínas, lípidos, lípidos de origen marino, aminoácidos, glúcidos o carbohidratos, vitaminas, minerales, fibras dietarias y hierbas con las limitaciones indicadas en el punto 3, todos en concentraciones tales que no tengan indicación terapéutica o sean aplicables a estados patológicos.
Los Suplementos Dietarios de lípidos marinos estarán constituidos por un aceite aislado o mezcla de aceite de peces u otros organismos marinos.
En el caso de estar constituidos por triglicéridos de peces u otros organismos marinos, deberán presentar un contenido de ácido eicosapentaenoico (EPA) y de ácido decosahexaenoico (DHA) no menores de 6% cada uno y cuando se encuentren constituidos por concentrados de triglicéridos de aceite de pescado u otros organismos marinos, deberán presentar un contenido de ácido eicosapentaenoico (EPA) y de ácido cocosa hexaenoico (DHA) no menores de 15 y 10% respectivamente.
El aceite de germen de prímula, familia de las onagráceas (Oenothera biennis) deberá responder a las siguientes exigencias:
- Apariencia: De amarillo claro o amarillo verdoso, libre de materiales extraños e inmiscible con el agua.
- Sabor o color: Característico del aceite, sabor y olor suave, sin indicios de rancidez u otra anormalidad en los ensayos organolépticos.
- Densidad a 20 °C: 0,915 - 0,930 g/ml.
- Indice de peróxido: No más de 10 mEq 02/Kg de aceite.
- Indice de acidez: No más de 10 mg KOH/Kg de aceite.
- Solvente residual: No más de 1 ppm (Hexano).
- Indice de iodo: 150 - 160.
- Humedad: No más de 0,1%.
Los límites máximos de tolerancia de contaminantes inorgánicos serán los establecidos en el presente Código.
No se autorizarán suplementos dietarios que contengan Triptofano agregado en su formulación.
3- Las hierbas, que no se encuentren descriptas en este Código, y se soliciten como ingredientes de suplementos dietarios deberán ser previamente aprobadas por la Autoridad Sanitaria Nacional.
4- Defínese como Ingesta Diaria de Referencia (IDR) al nivel de ingesta diaria que es suficiente para satisfacer los requerimientos de los nutrientes de casi todos los individuos de un grupo. Los nutrientes propuestos para suplementar la dieta deberán proveer no menos del 20% de la IDR de acuerdo a los valores que figuran en las Tablas del Artículo 1387.
5- Defínanse como Niveles de No Observación de Efectos Adversos (NOEA) a la ingesta máxima de determinado nutriente no asociada con efectos adversos. Los valores establecidos son los que figuran en la siguiente tabla que se transcribe a continuación:
NIVELES DE NO OBSERVACION DE EFECTOS ADVERSOS (NOEA)
Los suplementos dietarios para embarazadas, lactancia y niños no podrán superar los límites establecidos en la Tabla II: Ingesta Diaria Recomendada de Proteína, Vitaminas y Minerales para Mujeres Embarazadas o en Período de Lactancia, del artículo 1387.
6- Establécese que no se inscribirán en el Registro Nacional Unico (R.N.U.) de Productos, los Suplementos Dietarios que contengan nutrientes cuyos valores de ingesta diaria superen los niveles establecidos en el punto anterior, aun cuando no se les atribuyan indicaciones terapéuticas.
7- En el rótulo de todos los suplementos dietarios se consignarán asimismo las leyendas:
- "Consulte a su médico antes de consumir este producto".
- "No utilizar en caso de embarazo, lactancia ni en niños", salvo en aquellos productos que sean específicos para estos casos.
- "Mantener fuera del alcance de los niños".
- En el caso que superen los valores de IDR en el rótulo deberá consignarse la siguiente advertencia:
"Supera la ingesta diaria de referencia" en los nutrientes que correspondan.
a) En caso de suplementos dietarios que contengan en su composición Vitaminas Liposolubles (A, D, E, y/o K) en cantidad superior a la IDR en el rótulo deberá consignarse la siguiente advertencia:
"Este producto puede provocar efectos tóxicos por acumulación de vitaminas liposolubles (A, D, E, y/o K); no vuelva a consumirlo sin consultar a su médico".
b) En caso de contener en su composición Hierro en cantidad superior a la IDR deberá consignar la siguiente advertencia:
"Este producto contiene Hierro y debe ser consumido únicamente por individuos sanos, antes de consumirlo consulte a su médico".
c) En caso de contener en su composición Glúcidos deberá consignar la siguiente advertencia:
"Este producto no debe ser utilizado por diabéticos"
d) En caso de contener en su composición Cromo deberá consignar la siguiente advertencia:
"Diabéticos: este producto contiene cromo. Consulte a su médico".
e) En el caso de contener en su composición Ingredientes de Alto Valor Calórico deberá consignar la siguiente advertencia:
"Este producto está indicado para personas que realizan una actividad física que requiere un aporte de calorías diarias superior al promedio de la población (2000 cal/día). Su consumo debe realizarse bajo estricto control médico".
f) En el caso de contener en su composición Fenilalanina o Aspartamo deberá consignarse la siguiente advertencia:
"Contiene fenilalanina: contraindicado para fenilceturónicos" u otra similar.
El texto de todas las advertencias deberá tener caracteres de buen realce y visibilidad.
En ningún caso deberá figurar la expresión "Venta Libre".
8- El rótulo de los suplementos dietarios deberá cumplir los requisitos establecidos en este Código detallando la información nutricional, consignando el nombre de los nutrientes, sus contenidos por unidad o porción y el porcentaje de la IDR para cada uno de ellos de acuerdo a los valores establecidos en las Tablas del artículo 1387.
Las hierbas deberán declararse en el listado de ingredientes mediante su denominación común, denominación botánica y mencionando la parte somática de la planta utilizada.
Asimismo deberá figurar la fecha de vencimiento del producto, las condiciones de almacenamiento del mismo y de corresponder, la forma de conservación una vez abierto el envase.
9- En el rótulo, como en la publicidad de los suplementos dietarios no deberán figurar indicaciones terapéuticas atribuibles a los mismos. Asimismo no deberán incluirse en los mismos afirmaciones que no estén demostradas científicamente y/o que puedan inducir a error en cuanto a las propiedades del producto.
10- El sobrerrótulo (rótulo complementario), de los suplementos dietarios importados deberá estar escrito en idioma español; el tamaño de la letra utilizada deberá garantizar su lectura, sin necesidad de instrumentos ópticos por personas de visión normal o corregida. No deberá contener textos que contravengan lo establecido en los incisos precedentes.
11- A los efectos de la elaboración, importación y/o, exportación de los Suplementos Dietarios se deberá solicitar previamente la inscripción en el Registro ante la Autoridad Sanitaria competente, cumplimentando los requisitos de información y documentación correspondiente.
12- Para la obtención de la autorización mencionada en el inciso precedente, sin perjuicio de los requisitos que la Autoridad Competente determine, se evaluará y aprobará el rótulo y sobrerrótulo de cada producto. A tal fin se exigirá la presentación del proyecto de rótulo redactado de acuerdo a lo establecido en los puntos 7 a 10 del presente artículo.
13- El material de promoción o publicidad del suplemento dietario que tenga tránsito federal, cualquiera fuera el medio empleado para su difusión, deberá estar autorizado previamente por la Autoridad Sanitaria Nacional. El contenido de la publicidad no podrá modificar la información de los rótulos aprobados. En el caso de incluirse en la publicidad información adicional que, por razones de espacio no estuviese incluida en el rótulo, la misma deberá estar avalada por trabajos científicos internacionales.
14- Para los productos a ser importados se define como evidencia de comercialización, la documentación probatoria autorizando el consumo del Suplemento Dietario en el mercado interno del país de origen. A los efectos del cumplimiento del presente inciso será aceptado únicamente el Certificado de Libre Venta expedido por el organismo gubernamental competente del país invocado.
15- Las autorizaciones de comercialización de los Suplementos Dietarios tendrán una validez de cinco (5) años. Sin perjuicio de ello, la Autoridad Sanitaria Nacional podrá disponer la prohibición de venta de tales productos cuando razones de orden científico-técnico permitan concluir que su consumo resulta perjudicial para la salud de la población.
16- El titular del producto será solidariamente responsable, con el Director Técnico del establecimiento, del cumplimiento de lo establecido en el presente artículo."
Art
1381 bis - (R.Conj SPReI 76/2009 y SAGPyA 391/2009)
Se denomina aceite de Chía, el obtenido de semillas de Salvia hispánica
L.
El aceite de Chía deberá responder a las siguientes exigencias:
- Aspecto: color amarillo claro, brillante, libre de materiales extraños e inmiscibles con el agua.
- Sabor y aroma: Característico del aceite, sabor y olor suave, sin indicios de rancidez u otra anormalidad en los ensayos organolépticos.
- Acidez libre: menos del 1%
- Indice de iodo: 205-215
- Composición de ácidos grasos determinada por cromatografía en fase gaseosa (ésteres metílicos por ciento)
Acido mirístico (C 14:0): 0.04
Acido palmítico (C16:0): 6.7
Acido palmitoleico (C16:1): 0.1
Acido esteárico (C18:0): 3.0
Acido oleico (C 18:1): 7.0
Acido linoleico (C18:2): 21.0
Acido linolénico (C 18:3): 60
Relación n-6/n-3: 0.35
Los límites máximos de tolerancia de contaminantes inorgánicos serán los establecidos en el presente Código.
Sólo se autorizará el aceite de chía para uso exclusivo en suplementos dietarios en los términos del artículo 1381 del presente Código.
Art 1382 - "Se entiende por Calostro Bovino o Calostro, el producto obtenido por el ordeño total e ininterrumpido de la vaca lechera en buen estado de salud y alimentación, realizado exclusivamente después de las primeras horas post-parto, en condiciones de higiene y hasta un máximo de diez días subsiguientes a la parición.
El calostro proveniente de otros animales deberá denominarse con el nombre de la especie productora.
Los tambos productores de calostro deberán cumplir con las exigencias del presente Código y, en particular deberán:
a) Ser oficialmente libres de Brucelosis y Tuberculosis de acuerdo a las exigencias establecidas por la Autoridad Sanitaria Nacional Competente.
b) Cumplir con las exigencias de sanidad de rodeos lecheros establecidas por la Autoridad Sanitaria Nacional Competente.
c) Contar con las instalaciones aprobadas por la Autoridad Sanitaria Competente para la obtención de calostro y separadas de forma tal de asegurar que la obtención, enfriamiento, almacenamiento, conservación y transporte para su procesamiento industrial posterior se realice en forma totalmente separada de las mismas operaciones efectuadas para la leche. Esta exigencia deberá ser demostrada a través de los registros de trazabilidad pertinentes.
d) Realizar las operaciones de obtención, enfriamiento, almacenamiento, conservación y transporte posterior bajo la supervisión directa de un Profesional Universitario, el cual será solidariamente responsable con el propietario del tambo del cumplimiento de las exigencias del presente Código.
El calostro deberá ser higienizado y enfriado inmediatamente después de su obtención a una temperatura no mayor a los 4° C, almacenado y transportado en condiciones higiénicas a una temperatura no mayor a los 8° C.
El calostro deberá responder a las siguientes exigencias:
|
Caseína |
4g/100 cm3 |
|
Proteínas de suero |
9-10 g/ 100 cm3 |
|
Materias Grasas |
6-6,6 g/100 cm3 |
|
Lactosa |
2,8-4 g/100 cm3 |
|
Cenizas |
1.1-1.6 g/100 cm3 |
|
Extracto seco total |
23-26 % g/100 cm3 |
|
Vitamina A |
700-900 Ul/ 100 cm3 |
|
Vitamina E |
400 mg/100 g de grasa |
|
Vitamina B1 |
60-100 ug/100 cm3 |
|
Vitamina B12 |
350-375 ug/100 cm3 |
|
Calcio |
170 mg/100 cm3 |
|
Fósforo |
150 mg/100 cm3 |
1. Bacterias mesófilas: menor a 10.000 ufc/cm3
2. Bacterias coliformes: ausencia en 1 cm3
3. Escherichia coli: ausencia en 1 cm3
4. Células somáticas por ml: menos de 300.000
5. Inmunoglobulinas (lgG): mayor 50 mg/cm3
Métodos sugeridos en cada determinación:
1. Agar nutritivo
2 y 3. Placa Agar-violeta-rojo-bilis
4. Recuento de células somáticas
6. Inmunodifusión radial o electroforesis capilar
Se considerará como calostro no apto para el consumo, aquel que tuviera:
1) Metales tóxicos, sustancias tóxicas y/o toxinas microbianas en cantidades superiores a las permitidas por el presente Código.
2) Aflatoxina M, en cantidad superior a 0.5 ug/litro. (Métodos de referencia: FIL 111A: 1990 o AOAC 16th Ed. 980.21).
3) Residuos de los siguientes antibióticos, en cantidades superiores a los máximos permisibles indicados a continuación:
|
Sustancias |
Límite Máximo (ug/l) |
Método de referencia |
|
|
Grupo |
Compuesto |
|
|
|
|
|
|
|
|
Beta-Lactámicos |
Penicilina |
4 |
FIL 57: 1970 |
|
Ampicilina |
4 |
AOAC 16th Ed. 982.18 |
|
|
Amoxicilina |
4 |
||
|
Cloxacilina |
30 |
||
|
Dicloxacilina |
30 |
||
|
Oxacilina |
30 |
||
|
Tetraciclinas |
100 |
AOAC 16th Ed. 995.04 |
|
|
Cloranfenicol |
- 0,1 |
|
|
|
Sulfonamidas |
100 |
AOAC 16th Ed. 993.32 |
|
|
Neomicina |
150 |
Swabtes + Bioensayo (USDA) |
|
|
Cefalosporinas |
Ceftiofur |
100 |
|
|
Macrólidos |
Spiramicina |
200 |
|
|
Otros |
Dapsona |
0 |
|
|
|
Nafcilina |
10 |
|
A los fines del control cualitativo rutinario, se podrán utilizar los métodos rápidos de detección (métodos de screening).
| Sustancias |
Métodos de detección |
| Beta-lactámicos |
Microbiológicos o Inmunoenzimáticos o colorimétricos |
| Tetraciclinas |
|
| Sulfonamidas |
Para determinar la aptitud sanitaria del calostro, deberá realizarse la confirmación y cuantificación de los residuos de antibióticos detectados por métodos de screening mediante la aplicación de los métodos de referencia.
4) Más de 0,2 ml/l. de ión nitrito y más de 5 mg/l. de ión nitrato.
5) Sustancias conservadoras y/o neutralizantes de cualquier naturaleza.
6) Una concentración de residuos de plaguicidas (LMR) - expresada en miligramo/kg - que superen los siguientes límites - Codex Alimentarius (Vol. II - Supl 1 - 1993 y Vol. II B - 1995):
|
PESTICIDAS |
LIMITE MAXIMO DE RESIDUOS (mg./kg.) |
|
2,4,5 - T |
0,05 |
|
2,4 D |
0,05* |
|
ACEFATO |
0,1 |
|
ALDICARB |
0,01* |
|
ALDRIN Y DIELDRIN |
0,006 (E) (F) |
|
AMITRAZ |
0,01* |
|
ANILAZINA |
0,01 (*) |
|
AZOCICLOTIN |
0,05* |
|
BENDIOCARB |
0,05* |
|
CARBARILO |
0,1* |
|
CARBENDAZIM |
0,1* |
|
CARBOFURAM |
0,05* |
|
CIFLUTRINA |
0,01 (F) |
|
CIHEXATIN |
0,05* |
|
CIPERMETRIN |
0,05 (F) |
|
CIROMACINA |
0,01* |
|
CLOFENTEZINA |
0,01 (*) |
|
CLORDANO |
0,002 (E) (F) |
|
CLORFENVINFOS |
0,008 |
|
CLORMEQUAT |
0,1* |
|
CLORPIRIFOS |
0,01* (F) |
|
DDT |
0,05 (E) (F) |
|
DELTAMETRIN |
0,02 (F) |
|
DIAZINON |
0,02 (F) |
|
DICOFOL |
0,05 (F) |
|
DICLORVOS (DDVP) |
0,02* |
|
DIFLUBENZURON |
0,05* |
|
DIMETIPIN |
0,02* |
|
DIQUAT |
0,01* |
|
EDIFENFOS |
0,01* |
|
ENDOSULFAN |
0,004 (F) |
|
ENDRIN O ENDRINA |
0,0008 (E) (F) |
|
ETIOFENCARB |
0,02* |
|
ETION |
0,02 (F) |
|
ETRINFOS |
0,01* (F) |
|
FENCLORFOS |
0,08 |
|
FENITROTION |
0,002* (E) |
|
FENOBUTATIN OXIDO |
0,05* |
|
FENTION |
0,05 (F) |
|
FENTOATO |
0,01* (F) |
|
FENVALERATO |
0,1 (F) |
|
FLUSILAZOL |
0,01* |
|
FORATO |
0,05 |
|
FOSMET |
0,02* (F) |
|
FOXIM |
0,05 (F) |
|
GLIFOSATO |
0,1* |
|
HEPTACLORO Y HEPTACLORO |
0,006 (E) (F) |
|
EPOXIDO |
|
|
LINDANO (GAMA HCH) |
0,01 (F) |
|
MECARBAM |
0,01 |
|
METACRIFOS |
0,01* (F) |
|
METAMIDOFOS |
0,01* |
|
METIDATION |
0,001* (F) |
|
METIOCARB |
0,05* |
|
METOMILO |
0,02* |
|
METOPRENO |
0,05 (F) |
|
MICLOBUTANIL |
0,01* |
|
MONOCROTOFOS |
0,002* |
|
PARAQUAT |
0,01* |
|
PENCONAZOL |
0,01* |
|
PERMETRIN |
0,1 (F) |
|
PIRIMICARB |
0,05* |
|
PIRIMIFOS METILO |
0,05* (F) |
|
PROCLORAZ |
0,1* |
|
PROFENOFOS |
0,01* |
|
PROPARGITA |
0,1 (F) |
|
PROPICONAZOL |
0,01* |
|
PROPOXUR |
0,05* |
|
QUINOMETIONATO |
0,01* |
|
TERBUFOS |
0,01* |
|
TIABENDAZOL |
0,1* |
|
TRIADIMEFON |
0,1* |
|
TRIADIMENOL |
0,01* |
|
TRIAZOFOS |
0,01* |
|
TRICLORFON |
0,05 |
|
VINCLOZOLIN |
0,05* |
|
Referencias: * Valor en el límite de determinación o próximo al mismo. (E) Límite para residuos extraños / (F) Residuo liposoluble |
|
7) Una concentración de residuos de medicamentos veterinarios antiparasitarios (LMR) - expresada en u g/kg - que superen los siguientes límites - Codex Alimentarius (Vol. III - 1995)
| Sustancias |
Límite Máximo de Residuos (ug/kg) |
Método de referencia |
|
ALBENDAZOL |
100 (*) |
HPLC |
|
ISOMETAMIDIO |
100 |
|
|
IVERMECTINA |
4 (**) |
HPLC |
|
FENBENDAZOL |
|
|
|
OXIFENDAZOL |
100 (***) |
HPLC |
|
FEBANTEL |
|
|
|
LEVAMISOL |
10 |
HPLC O GC |
|
TIABENDAZOL |
100 |
|
Referencias:
(*) LMR expresado para el metabolito 2 - Amino sulfona
(**) Corresponde a 22-23 dihydroavermectina
(***) Sulfona de oxifendazol considerando la suma de los tres."
Art 1383 - (R.Conj SPReI 131/2011 y SAGPyA 414/2011) Se entiende por "alimento libre de gluten" el que está preparado únicamente con ingredientes que por su origen natural y por la aplicación de buenas prácticas de elaboración —que impidan la contaminación cruzada— no contiene prolaminas procedentes del trigo, de todas las especies de Triticum, como la escaña común (Triticum spelta L.), kamut (Triticum polonicum L.), de trigo duro, centeno, cebada, avena ni de sus variedades cruzadas. El contenido de gluten no podrá superar el máximo de 10mg/Kg. Para comprobar condición de libre de gluten deberá utilizarse metodología analítica basada en la Norma Codex STAN 118-79 (adoptada en 1979, enmendada en 1983; revisada en 2008) enzimoinmunoensayo ELISA R5 Méndez y toda aquella que Autoridad Sanitaria Nacional evalúe y acepte.
Estos productos se rotularán con la denominación del producto que se trate seguido de la indicación "libre de gluten" debiendo incluir además la leyenda "Sin TACC" en las proximidades de la denominación del producto con caracteres de buen realce, tamaño y visibilidad.
A los efectos de la inclusión en el rótulo de la leyenda "Sin TACC", la elaboración de los productos deberá cumplir con las exigencias del presente Código para alimentos libres de gluten.
Para la aprobación de los alimentos libres de gluten, los elaboradores y/o importadores deberán presentar ante la Autoridad Sanitaria de su jurisdicción: análisis que ‘avalen la condición de "libre de gluten" otorgado por un organismo oficial o entidad con reconocimiento oficial y un programa de buenas prácticas de fabricación, con el fin de asegurar la no contaminación con derivados de trigo, avena, cebada y centeno en los procesos, desde la recepción de las materias primas hasta la comercialización del producto fina.
Art 1384 - (Res. Conj. 94/2008 SPReI Y 357/2008
SAGPyA) - Se autorizarán los propóleos definidos en el Artículo
1308 bis como ingrediente únicamente de los siguientes productos:
1. Caramelos con propóleos.
2. Mieles con propóleos, las que podrán contener además polen y/o
jalea real.
3. Propóleos en solución hidroalcohólica de etanol o propilenglicol.
4. Suplementos dietarios.
A los efectos de la aprobación deberá presentarse el análisis
del producto final, que avale la cantidad de propóleos presente en el
mismo, mediante una titulación de flavonoides según Normas IRAM
15935-1- PROPOLEOS BRUTO y 15935-2- EXTRACTO DE PROPOLEOS.
El consumo diario de propóleos de acuerdo al modo de uso no podrá superar
300 mg/día para adultos y 150 mg/día para niños menores
de 12 años.
En el rótulo de estos productos alimenticios se deberá consignar, además
de las exigencias generales de rotulado y la denominación asignada por
la Autoridad Sanitaria, lo siguiente:
a) El contenido porcentual de propóleos que aporta el producto.
b) La leyenda: ‘MANTENER EN LUGAR FRESCO, SECO Y PROTEGIDO DE LA LUZ’.
c) La ingesta diaria máxima de propóleos para adultos: 300 mg.
d) La ingesta diaria máxima de propóleos para niños menores de
12 años: 150 mg.
e) El modo de uso en el que se deberá indicar en forma clara que la porción
consumida por día no debe superar lo establecido en c) y d).
f) Las leyendas: ‘CONTIENE PROPOLEOS. PERSONAS ALERGICAS O SENSIBLES. NIÑOS
MENORES DE 4 AÑOS, MUJERES EMBARAZADAS O EN PERIODO DE LACTANCIA: NO
CONSUMIRLO’.
No se podrán mencionar propiedades de prevención ni tratamiento de enfermedades
en el rótulo ni en la publicidad de los productos que contienen propóleos.
Estos productos se denominarán:
1. ‘Caramelos
con... % propóleos’ llenando el espacio con el dato de acuerdo
al porcentaje de propóleos que contengan.
Los caramelos
no podrán expenderse sueltos sino en envases secundarios con la rotulación
correspondiente. De acuerdo con el artículo 1341 del Código Alimentario
Argentino no podrán fraccionarse para ser expendidos individualmente.
2. ‘Miel
con... % propóleos’, llenando el espacio con el dato de acuerdo
al contenido de propóleos y/o ‘Miel con... % propóleos,
polen y/o jalea real’.
3. ‘Propóleos
al...% en solución hidroalcohólica de etanol o de propilenglicol’
según corresponda, llenando el espacio con el dato de acuerdo al contenido
de propóleos.
4. Para
el caso de los suplementos dietarios se rotularán con la denominación
de venta correspondiente, indicando además que contiene… % de propóleos,
llenando el espacio con el dato de acuerdo al contenido de propóleos."
Art
1385 - (R. Conj. 95/2008 y 358/2008) - Se entiende por Fibra Alimentaria a cualquier
material comestible que no sea hidrolizado por las enzimas endógenas
del tracto digestivo humano.
Incluye
polisacáridos no almidón, pectinas, almidón resistente,
inulina, oligofructosa, polidextrosa, maltodextrinas resistentes, fructooligosacáridos
(FOS), galactooligosacáridos (GOS), transgalactooligosacáridos
(TOS), y todos los que en el futuro incorpore la Autoridad Sanitaria Nacional.
Se
entiende por Fructooligosacáridos (FOS) a los oligosacáridos de
fructosa con uniones b 2-1 de origen natural o sintético.
Se entiende por Inulina el fructano natural constituido por unidades de fructosil
con uniones b -2,1 terminado en una unidad de glucosa. La longitud de la cadena
es generalmente de 2 a 60 unidades.
Se
entiende por Oligofructosa natural el producto constituido por 3 a 5 unidades
de fructosa con una unidad terminal de glucosa. La oligofructosa sintética
contiene b -2,1 cadenas de fructosa con o sin unidades de glucosa terminales.
Las cadenas varían de 2 a 8 residuos de monosacáridos.
Se
entiende por Fructooligosacáridos (FOS) sintético el producto
de la hidrólisis enzimática (enzima fructofuranosidasa fúngica)
de la inulina o de la síntesis o de la transfructosilación de
la sacarosa. Los FOS sintéticos poseen la misma composición química
y estructural que la oligofructosa, excepto que el promedio de los grados de
polimerización es de 2 a 4.
Se
entiende por Galactooligosacáridos (GOS) el oligosacárido no digerible
(3 a 10 grados de polimerización) compuesto por unidades de galactosa.
Se
entiende por Transgalactooligosacáridos (TOS o TGOS) el producto de la
transgalactosilación enzimática de la lactosa. Los oligómeros
son lineales y consisten en moléculas de lactosa con varias galactosas
con uniones b -1,6 y b -1,4.
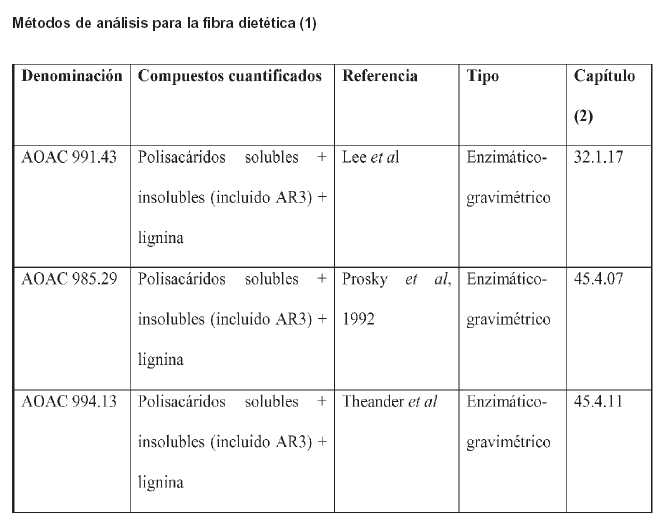
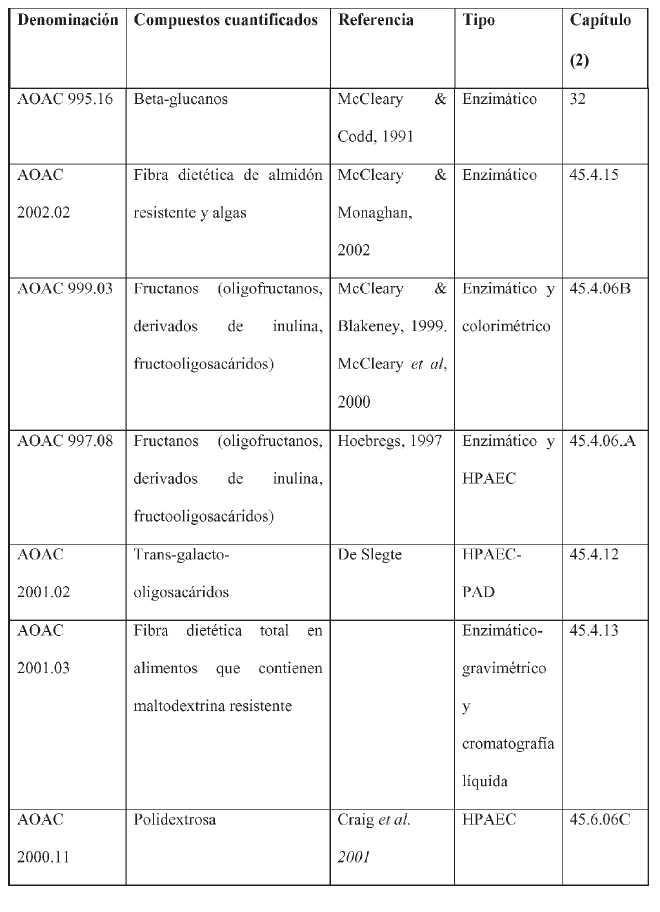
Como se presentan en CX/NSFDU 04/3-Add.1.
Métodos oficiales de AOAC Internacional. 17ª edición. Volumen II. Horwitz, editor.
Para el cálculo del Valor Energético se considerará el siguiente factor:
- Fibra Alimentaria: 0 Kcal/g."
Art 1386 - (Res. Conj. 95/2008 SPReI Y 358/2008 SAGPyA) - Se entiende por alimentos modificados en fibra a aquellos productos a los que se les han agregado fibras contempladas en el presente Código y las que en el futuro incorpore la Autoridad Sanitaria Nacional. Deberán contener como mínimo de fibra alimentaria:
3 g /100 g para sólidos
1 g /100 ml para líquidos
No deberán presentar una disminución, con respecto a los alimentos corrientes, de los contenidos de nutrientes, los cuales deberán incorporarse en la cantidad que corresponda, a tales efectos.
Los productos modificados en fibra que naturalmente la/s contuviere/n en su composición se denominarán ‘X fortificado con …’ (donde X significa denominación específica del alimento) llenando el espacio en blanco con la/s fibra/s que se adicione/n, con letras de igual tamaño, realce y visibilidad.
Los productos modificados en fibra que naturalmente no la/s contuviere/n en su composición se denominarán ‘X adicionado con…’ (donde X significa denominación específica del alimento) llenando el espacio en blanco con la/s fibra/s que se adicione/n, con letras de igual tamaño, realce y visibilidad."
Art 1387 - (Res. Con. 118/2008 SPReI y 474/2008 SAGPyA) - Las siguientes tablas serán utilizadas para el diseño, formulación y rotulado de productos alimenticios destinados a personas con trastornos metabólicos específicos y/o condiciones fisiológicas particulares, que no se encuentren alcanzados por la Resolución GMC Nº 46/03 – Reglamento Técnico MERCOSUR sobre Rotulado Nutricional de Alimentos Envasados o sus modificatorias.
Cuando un alimento no esté formulado para un género específico, se utilizarán los valores de Ingesta Diaria Recomendada (IDR) correspondientes a los hombres.
Estas tablas podrán ser complementadas para el caso de poblaciones específicas no contempladas por la presente Resolución, debiendo ser las mismas determinadas por la Autoridad Sanitaria Nacional.
Tabla I: Ingesta Diaria Recomendada de Proteína, Vitaminas y Minerales para Adultos
Tabla II: Ingesta Diaria Recomendada de Proteína, Vitaminas y Minerales para Mujeres Embarazadas o en Período de Lactancia
(1) Dietary Reference Intakes for Energy, Carbohydrate. Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Food and Nutrition Board, Institute of Medicine, National Academies Press, 2002/2005.
(2) Human Vitamin and Mineral Requirements, FAO/WHO, 2002.
(3) Dietary Reference Intakes (DRIs): Recommended Intakes for Individuals, Elements. Food and Nutrition Board, Institute of Medicine, National Academies Press, 2004.
(4) EN = equivalente de niacina, factor de conversión de triptófano a niacina 60 a 1.
(5) EDF = equivalente dietario de folato; ?g de EDF provistos = [?g de folato proveniente de los alimentos +(1,7 x ?g de ácido fólico sintético)].
(6) Ingestas seguras recomendadas como mcg RE/día; 1 mcg retinol = 1 mcg RE; 1 mcg b-caroteno = 0,167 mcg RE; 1 mcg de otros carotenoides provitamina A = 0,084 mcg RE.
(7) Niacina preformada.
(8) Los sustitutos de leche materna no deberían contener menos de 0,3 mg de equivalentes de a-tocoferol (TE)/100 ml de producto reconstituido, ni menos de 0,4 mg TE/g PUFA. El contenido de vitamina E de la leche materna humana, 2,7 mg por 850 ml de leche, es bastante constante.
(09) Fórmula infantil.
(10) Para niños alimentados con fórmulas infantiles.
(11) No aplicable a niños que consumen únicamente leche humana.
(A) Moderada biodisponibilidad.
(B)
10% de biodisponibilidad.
Art. 1388: (Res. Conj. N° 90/2013 SPReI y 121/2013 SAGyP) Se entiende por “Bebida analcohólica con cafeína y taurina” a aquella bebida no alcohólica gasificada o no que contenga en su composición cafeína y taurina, asociadas o no con glucuronolactona y/o inositol, con los valores máximos que se detallan a continuación:
- Taurina: 400 mg/100 ml
- Glucuronolactona: 250 mg/100 ml
- Cafeína: 32 mg/100 ml
- Inositol: 20 mg/100 ml
Podrá contener además hidratos de carbono, vitaminas, minerales y/o aminoácidos, y los otros ingredientes autorizados para bebidas analcohólicas por el presente Código.
Este producto se rotulará con la denominación de venta “Bebida analcohólica con cafeína y taurina”.
El rótulo deberá cumplir con las exigencias generales obligatorias establecidas en el presente Código para alimentos envasados y con la siguiente información obligatoria específica:
- El contenido en mg/100 ml de: taurina, glucuronolactona, cafeína e inositol en el listado de ingredientes.
- Los componentes cafeína, taurina, glucuronolactona, inositol y cualquier otro nutriente presente en el producto expresados en g, mg o µg según corresponda por porción establecida, en la Información Nutricional Obligatoria.
Deberá consignar además las siguientes leyendas obligatorias:
• “No consumir en caso de embarazo, lactancia, niños y personas de edad avanzada”.
• “Se sugiere no consumir con alcohol”.
• “Alto contenido de cafeína” cuando ésta supere los 20 mg/ 100 ml.
La publicidad de estas bebidas deberá cumplir con las exigencias establecidas en el presente Código, además de las siguientes restricciones, cualquiera sea el medio de difusión que se utilice:
a) No deben ser asociadas directa o indirectamente al consumo con bebidas alcohólicas.
b) No deben presentarse como productores de bienestar o salud.
c) Su consumo no debe vincularse con ideas o imágenes de mayor éxito en la vida afectiva y/o sexual de las personas o hacer exaltación de prestigio social, virilidad o femineidad.
d) En el mensaje no deben participar en imágenes o sonidos, menores de dieciocho (18) años de edad.
Art. 1388 bis: (Res. Conj. N° 90/2013 SPReI y 121/2013 SAGyP) Las bebidas mencionadas en el artículo 1388, que contengan además vitaminas y/o minerales que superen los valores de ingesta diaria recomendada del Capítulo V del presente Código y/o hierbas autorizadas para suplementos se rotularán con la denominación de venta: “Bebida analcohólica con cafeína y taurina suplementadas con…” (completando el espacio en blanco con las vitaminas y/o minerales que superen los valores de ingesta diaria recomendada y/o las hierbas autorizadas).
Artículo 1389: (Res. Conj. 261/2011 SPReI y 22/2011 SAGyP) Con la denominación de Probióticos, se entiende los microorganismos vivos que, administrados en cantidades adecuadas, confieren beneficios para la salud del consumidor.
Para que una cepa pueda ser utilizada como ingrediente probiótico para alimentos deberá cumplir con el siguiente protocolo de Evaluación de un Probiótico como ingrediente para Alimentos:
I. Requisitos Mínimos
1. Identificación de la cepa (Género/especie/subespecie)
Los análisis para la identificación de la cepa deberán ser llevados a cabo por laboratorios reconocidos por la Autoridad Sanitaria o internacionalmente mediante metodología validada.
El método recomendado para la identificación de las cepas de probióticos por técnicas moleculares es el de la secuenciación del 16SrDNA obtenido a partir del 16SrRNA, de acuerdo con: “Sambrook, J. and D. W. Russell. 2001. Molecular Cloning: A Laboratory Manual, Third ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY”.
2. Caracterización “in Vitro” e “in Vivo”
• Resistencia gástrica: ensayo realizado como indicador de que la cepa podrá atravesar la barrera biológica estomacal, arribando viable al intestino. Deberá observarse supervivencia de la cepa en una solución gástrica simulada, a 37º C y en condiciones estandarizadas (tiempo y pH).
• Resistencia a bilis: ensayo realizado como indicador de resistencia de la cepa a esta barrera biológica del organismo, presente a nivel de duodeno. Deberá presentar capacidad de desarrollo en un medio de cultivo adicionado de bilis bovina al 0,3% (entendida como la concentración fisiológica), a 37º C y en condiciones estandarizadas (medio de cultivo y tiempo).
• Resistencia a lisozima (opcional): ensayo realizado como indicador de que la cepa podrá sortear esta barrera biológica presente en la boca (saliva) e intestino delgado. Deberá presentar capacidad de desarrollo en un medio de cultivo adicionado de lísozima, a 37º C y en condiciones estandarizadas (concentración de lisozima, medio de cultivo y tiempo).
3. Ensayos “in Vivo” e “in Vitro” que demuestren el(los) efecto(s) probiótico(s) adjudicado(s) debidamente documentados y respaldados en estudios efectuados por organismos nacionales y/o internacionalmente reconocidos.
4. Seguridad
La cepa probiótíca no debe ser riesgosa para la salud. La bacteria no deberá presentar o promover la translocación bacteriana (pásaje de bacterias del intestino más allá de los nódulos mesentéricos) en las concentraciones en que se encuentra en el alimento. Puede ser medida sembrando en placas agarizadas muestras de sangre y de homogenizados de tejidos de nódulos linfáticos mesentéricos, bazo e hígado de animales de experimentación.
Además se realizarán las pruebas complementarias descriptas en el punto II.
II. Pruebas Complementarias para Garantizar la Seguridad de la Cepa
• Resistencia a antibióticos: ensayo realizado como indicador de la presencia de cepas portadoras de genes de resistencia. Visto que la diseminación de antibiótico-resistencia puede reducir las posibilidades terapéuticas en enfermedades infecciosas, se deberá determinar la presencia de resistencia transferible en cepas que serán usadas para consumo humano. Las cepas no deberán ser portadoras de genes de resistencia a antibióticos.
• Actividad hemolítica: ensayo realizado como indicador de la presencia del factor de virulencia responsable de actividad hemolítica. Dicho factor es utilizado principalmente por ciertos microorganismos como fuente de hierro, motivo por el cual causa anemia y edema. Deberá estar ausente en bacterias probióticas.
• Producción de toxinas: las cepas probióticas no deberán producir toxinas. La toxicidad de las cepas hacia la mucosa del tracto gastrointestinal es considerada un importante aspecto de seguridad. La toxicidad aguda se determina comúnmente en ratones, durante el ensayo en el cual se suministra a los animales una determinada dosis de bacterias (equivalente a la dosis que contendrá el alimento) se observan diariamente posibles cambios en la actividad y comportamiento de los mismos. Después del ensayo, los animales son sacrificados para detectar existencia de cambios patológicos visibles en órganos (estómago, porción dista) del ileum, cecum y colon).
III. Identificación Comercial de la(s) Cepa(s)
El producto se presentará comercialmente en un envase bromatológicamente apto cuyo rótulo indique la identificación precisa de la(s) cepa(s) que lo componga(n) y la concentración de células viables de cada una de ellas (UFC/g) Con la denominación de Alimento con Probióticos, se entiende aquel alimento con una carga de células viables que deberá estar comprendida entre 106 y 109 UFC/g durante su período de duración mínima.
El producto se rotulará: “... con probióticos” llenando el espacio en blanco con la denominación de venta del alimento correspondiente.
Los alimentos elaborados con probióticos serán autorizados, previa evaluación satisfactoria de los ensayos “in Vivo” con el alimento tal cual se va a consumir, que demuestren la funcionalidad que se le atribuye a la(s) cepa(s) probiótica(s) que contiene, de una Comisión Evaluadora integrada por profesionales especializados pertenecientes a la Autoridad Sanitaria o a los que ésta designe a ese efecto para cada caso particular.
La Comisión Evaluadora determinará si es necesario la repetición de los ensayos “in Vivo” para aquellos alimentos en los cuales se demuestre que una modificación en la composición del alimento, sobre el cual se llevaron a cabo los ensayos “in Vivo”, no altera el o los efectos probióticos que se intentan demostrar.
Art 1390 -
Con la denominación de Prebiótico, se entiende el ingrediente alimentario o parte de él (no digerible) que posee un efecto benéfico para el organismo receptor, estimulando el crecimiento selectivo y/o actividad de una o de un número limitado de bacterias en el colon y que confiere beneficios para su salud.
Para que un compuesto pueda ser utilizado como ingrediente prebiótico para alimentos deberá cumplir con el siguiente protocolo de Evaluación de un Prebiótico como ingrediente para Alimentos:
I. Requisitos Mínimos
1. Identificación del compuesto
• Nombres químicos.
• Caracterización físico-química.
• Descripción.
• Fuente/Origen.
• Pureza.
• Contaminantes.
2. Caracterización del prebiótico
• Resistencia a la acidez gástrica: ensayo realizado como indicador de que el prebiótico no es modificado por la acidez estomacal.
• Resistencia a la hidrólisis por enzimas de mamíferos: ensayo realizado como indicador de que el prebiótico no es afectado por enzimas presentes en la saliva, así como enzimas pancreáticas e intestinales.
• Resistencia a la absorción gastrointestinal: ensayo realizado como indicador de que el prebiótico no se absorbe a nivel del epitelio intestinal.
• Fermentación por la microflora intestinal.
• Estimulación selectiva del crecimiento y/o actividad de bacterias intestinales benéficas que contribuyen a la salud y bienestar: ensayo realizado como indicador de que el prebiótico es utilizado como nutriente selectivamente por la microflora intestinal considerada benéfica. Deberá observarse crecimiento de bacterias benéficas y no deberá observarse crecimiento de otra microflora intestinal.
3. Ensayos “in Vivo” e “in Vitro” que demuestren el(los) efecto(s) fisiológico(s) adjudicado(s) al prebiótico debidamente documentados y respaldados en estudios efectuados por organismos nacionales y/o internacionalmente reconocidos.
4. Seguridad
El compuesto prebiótico no debe ser riesgoso para la salud. Deberá demostrarse mediante ensayos de toxicidad aguda, subaguda y crónica debidamente documentados y respaldados en estudios efectuados por organismos nacionales y/o internacionalmente reconocidos.
II. Identificación Comercial del o los Compuestos
El producto se presentará comercialmente en un envase bromatológicamente apto cuyo rótulo indique la identificación precisa del o los componentes que lo componga(n).
Con la denominación de Alimento con Prebióticos, se entiende aquel alimento adicionado con un prebiótico autorizado.
El producto se rotulará: “...con prebióticos” llenando el espacio en blanco con la denominación de venta del alimento correspondiente.
Los alimentos elaborados con prebióticos serán autorizados, previa evaluación satisfactoria de los ensayos “in Vivo” en el alimento tal cual se va a consumir, que demuestren la funcionalidad que se le atribuye a él o a los compuesto(s) prebiótico(s) que contiene, de una Comisión Evaluadora integrada por profesionales especializados pertenecientes a la Autoridad Sanitaria o a los que ésta designe a ese efecto para cada caso particular.
La Comisión Evaluadora determinará si es necesario la repetición de los ensayos “in Vivo” para aquellos alimentos en los cuales se demuestre que una modificación en la composición del alimento, sobre el cual se llevaron a cabo los ensayos “in Vivo”, no altera el o los efectos prebióticos que se intentan demostrar.